|
|
მთავარი - ბიბლიოთეკის შესახებ - ელ.რესურსები |
 |
ანგარიში სამედიცინო და ფარმაცევტულ სფეროში ლიცენზიისა და ნებართვის სისტემის შესახებ |
|
|
| საბიბლიოთეკო ჩანაწერი: |
| თემატური კატალოგი ეკონომიკა |
| საავტორო უფლებები: ©საქართველოს ახალგაზრდა ეკონომისტთა ასოციაცია |
| თარიღი: 2003 |
| კოლექციის შემქმნელი: სამოქალაქო განათლების განყოფილება |
| აღწერა: საქართველოს ახალგაზრდა ეკონომისტთა ასოციაცია საქართველოს შრომის, ჯანმრთელობისა და სოციალური დაცვის სამინისტრო გამოცემულია აშშ-ის საერთაშორისო განვითარების სააგენტოს (USAID) და მერილენდის უნივერსიტეტის IRIS Centre-ის ფინანსური მხარდაჭერით (კონტრაქტი №114-C-00-01-00136-00). გამოცემაში გამოთქმული მოსაზრებები ეკუთვნით მათ ავტორებს და შესაძლოა არ ემთხვეოდეს USAID-ის თვალსაზრისს. Published with the financial support of the United States Agency for International Development (USAID) through the IRIS Centre at the University of Maryland (contract№114-C-00-01-00136-00). Any opinions expressed in this publication are those of author(s) and do not necessary reflect the views of the USAID. ანგარიში მომზადებულია „ლიცენზიისა და ნებართვის დანერგვის პროექტის” ფარგლებში. პროექტი ხორცილედება საქართველოს ახალგაზრდა ეკონომისტთა ასოციაციის მიერ IRIS-Center-ის მახრადჭერით. პროექტის დირექტორი: ანი ქათამიძე ექსპერტები: ლევან ბეჟაშვილი ნიკო თევდორაშვილი შოთა გვენეტაძე ლევან გუგუტიშვილი ირაკლი ნარმანია © საქართველოს ახალგაზრდა ეკონომისტთა ასოციაცია საქართველო, თბილისი, 0105; ვ. ორბელიანის 35, ტელ. 92-28-39; 99-04-43 www.economists.ge E-mail: office@economists.ge პროექტი ხორციელდებაn IRIS Centre -ის და USAID-ის მხარდაჭერით |
 |
1 შესავალი |
▲back to top |
საქართველოსათვის ჯანდაცვის სისტემის რეფორმა მეტად მნიშვნელოვანია. საბჭოთა კავშირის ჯანდაცვის სისტემის შენარჩუნება საკმაოდ ძვირადღირებული აღმოჩნდა, ამასთანავე, ქვეყანაში მიმდინარე სოციალურეკონომიკური ფორმაციის ცვლილების ფონზე იგი არაადეკვატური გახდა.
უახლეს ისტორიაში განვითარებული მოვლენების გამო, სიტყვა რეფორმა მოსახლეობაში არაერთგვაროვან დამოკიდებელებას იწვევს. განსაკუთრებით საგრძნობია ჯანდაცვის რეფორმისადმი საზოგადოების ნეგატიური დამოკიდებულება. იქმნება საშიშროება, სერიოზულად დამახინჯდეს მისი არსი, რომ არაფერი ვთქვათ მის სრულებით შეჩერებაზე.
მიმდინარე ეტაპზე ერთ-ერთ რთულ საკითხს ჯანდაცვის სფეროს სახელმწიფოს მხრიდან დაფინანსება წარმოადგენს. მათ შორის ისეთი წყაროებიდან, როგორიცაა: ცენტრალური და ადგილობრივი ბიუჯეტები, ბიუჯეტგარეშე სახელმწიფო ფონდები, სოციალური დაზღვევის ერთიანი სახელმწიფო ფონდი. სახელმწიფო საგადასახადო შემოსავლების და ინსტიტუციონალური განვითარების დაბალი დონე არ იძლევა საშუალებას, ერთი მხრივ, სახელმწიფო დაფინანსების გაზრდისა და, მეორე მხრივ, უახლოეს პერიოდში კერძო სადაზღვევო და ჯანდაცვის სისტემის განვითარებისათვის.
ზემოთ აღნიშნული პრობლემების გადაწყვეტაში მნიშვნელოვანი როლი კერძო სექტორმა უნდა შეასრულოს. მხოლოდ კერძო სექტორის გააქტიურებას შეუძლია გადაწყვიტოს საქართველოში არსებული პრობლემები. აქედან გამომდინარე, აუცილებელია, კერძო სექტორს საქმიანობისათვის ხელსაყრელი გარემო შეექმნას.
ამ მიმართულებით, უდიდესი მნიშვნელობა ენიჭება სამედიცინო და ფარმაცევტული საქმიანობის სფეროში მაღალკონკურენტული გარემოს ჩამოყალიბებასა და განვითარებას. კონკურენტული გარემო საფუძველია ისეთი დადებითი ფაქტორებისა, როგორიცაა: ჯანდაცვის სისტემაში მომსახურების მთელი კომპლექსის ხელმისაწვდომობა და ხარისხის ზრდა. ეს ფაქტორები უშუალოდ უკავშირდება სოციალურად დაუცველი ფენების მოთხოვნებს, რომელსაც სახელმწიფო სრულად ვერ აკმაყოფილებს.
ამ სფეროში მძლავრი კერძო სექტორის ჩამოყალიბებისა და განვითარების ერთ - ერთი მთავარი პრობლემაა:
1. კერძო და ყოფილი სახელმწიფო (100%-ანი სახელმწიფო წილის მქონე) სამედიცინო დაწესებულებებისათვის ერთიანი მოქმედების გარემოს ჩამოყალიბება. ეს პრობლემა, ერთი მხრივ, აისახება სახელმწიფო პროგრამების მიღების პროცესში თანასწორუფლებიანობის პრინციპის დაცვასა და, მეორე მხრივ, ერთიანი მარეგულირებელი გარემოს შექმნაში;
2. კაპიტალდაბანდებების მაღალი დონის საჭიროება;
3. სახელმწიფოს მხრიდან რეგულაციის სისტემების ზუსტი განსაზღვრა და ლიბერალიზაცია.
ერთ-ერთი მთავარი საკითხი, რომელიც ამ სფეროში კერძო სექტორის აქტიურ მონაწილეობას და განვითარებას ზღუდავს, არის სამედიცინო და ფარმაცევტული დაწესებულებების ლიცენზირების, ფარმაკოლოგიური პროდუქციის წარმოებისა და იმპორტის ნებართვებისა და რეგისტრაციის სფეროში არსებული მდგომარეობა. ლიცენზირებისა და ნებართვების მექანიზმი კეთილსინდისიერი მეწარმეობის შემზღუდავ ფაქტორად არ უნდა იქცეს. რეგულირების ამ ფორმამ გადაწყვეტი როლი უნდა შეასრულოს ერთი მხრივ, სამედიცინო მომსახურების ხარისხის გაუმჯობესებაში (წინასწარ განსაზღვრული გარდამავალი ეტაპების მიხედვით) და მეორე მხრივ, მაქსიმალურად უნდა გამორიცხოს კორუფციული მექანიზმები საქმიანობის დაწყებისა და შემდგომი წარმართვის პროცესში.
„ლიცენზიისა და ნებართვის დანერგვის“ პროექტის საფუძველზე, ჩვენი კვლევის განხორციელების კონკრეტული მიზნები შეიძლება, ძალიან მოკლედ, შემდეგნაირად ჩამოვაყალიბოთ:
1. სალიცენზიო და სანებართვო სისტემის დანერგვა, რომელიც გამოიხატება არსებული კანონის სამედიცინო და ფარმაცვტულ დაწესებულებამდე მიტანაში;
2. ლიცენზირებისა და ნებართვების სისტემის მონიტორინგი თუ როგორ ხორციელდება ახალი კანონმდებლობის აღსრულება და ადმინისტრაციული წარმოების განხორციელება;
3. ამ სფეროში არსებული მდგომარეობის გამჭვირვალობის პრინციპის დანერგვა;
4. კერძო სექტორის განვითარების აუცილებლობა და პოპულარიზაცია მოსახლეობაში;
 |
2 კანონმდებლობის ზოგადი მიმოხილვა |
▲back to top |
I თავი
დღეისათვის ჯანმრთელობის დაცვის სისტემას შემდეგი კანონები არეგულირებს:
1. ჯანმრთელობის დაცვის შესახებ;
2. წამლისა და ფარმაცევტული საქმიანობის შესახებ;
3. სამედიცინო და ფარმაცევტული საქმიანობის ლიცენზირების შესახებ;
4. ადამიანის იმუნოდეფიციტის ვირუსით ინფექციის (შიდსის) პროფილაქტიკის შესახებ;
5. სისხლისა და მისი კომპონენტების დონორობის შესახებ;
6. ფსიქიატრიული დახმარების შესახებ;
7. ბავშვთა ბუნებრივი კვების დაცვისა და ხელშეწყობის, ხელოვნური საკვების მოხმარების შესახებ;
8. ადამიანის ორგანოთა გადანერგვის შესახებ.
მიმდინარე მოხსენებაში განხილულია ის კანონები, რომლებიც უშუალოდ ეხება სამედიცინო და ფარმაცევტულ საქმიანობას და მათი ლიცენზირებისა და ნებართვების რეგულირების საკითხებს. აგრეთვე, ამ კანონების ურთიერთშესაბამისობას და არსებულ პრობლემებს.
„ჯანმრთელობის დაცვის შესახებ“ კანონის მიმოხილვა
1997 წლის 10 დეკემბერს ძალაში შევიდა კანონი „ჯანმრთელობის დაცვის შესახებ“, რომელმაც დაარეგულირა ურთიერთობები ჯანმრთელობის დაცვის სფეროში სახელმწიფო ხელისუფლების ორგანოებსა და ფიზიკურ და იურიდიულ პირებს შორის.
წინამდებარე კანონით ჯანმრთელობის დაცვის სფეროში განსაზღვრულია სახელმწიფო პოლიტიკის პრინციპები, რითაც უნდა იხელმძღვანელოს შრომის, ჯანმრთელობისა და სოციალური დაცვის სამინისტრომ, კერძოდ:
1. მოსახლეობის სამედიცინო დახმარების საყოველთაო და თანაბარი ხელმისაწვდომობა სახელმწიფოს მიერ ნაკისრი სახელმწიფო სამედიცინო პროგრამებით გათვალისწინებული ვალდებულების ფარგლებში;
2. ჯანმრთელობის დაცვის სფეროში ადამიანის უფლებათა და თავისუფლებათა ხელშეუვალობა, პაციენტის პატივის, ღირსებისა და მისი ავტონომიის აღიარება;
3. ექიმის და სხვა სამედიცინო პერსონალის დამოუკიდებლობის ცნობა საქართველოს კანონმდებლობით განსაზღვრულ ფარგლებში;
4. ქვეყნის ეკონომიკური განვითარების სტრატეგიასთან შესაბამისობა და სისტემის მართვადობის უზრუნველყოფა;
5. წინასწარ პატიმრობაში და სასჯელის აღსრულების დაწესებულებებში მყოფ პაციენტთა, აგრეთვე, ამა თუ იმ დაავადებით შეპყრობილთა დისკრიმინაციისაგან დაცვა;
6. სამედიცინო ეთიკის საყოველთაოდ აღიარებული ნორმების დამკვიდრება ჯანმრთელობის დაცვის სფეროში;
7. მოსახლეობის უზრუნველყოფა სრული ინფორმაციით სამედიცინო დახმარების ყველა არსებული ფორმისა და მისი მიღების შესაძლებლობის შესახებ;
8. ჯანმრთელობის დაცვის საერთაშორისო ორგანიზაციებთან თანამშრომლობის ხელშეწყობა;
9. სახელმწიფოს პასუხისმგებლობა სავალდებულო სამედიცინო დაზღვევის პროგრამით გათვალისწინებული სამედიცინო მომსახურების მოცულობასა და ხარისხზე;
10. პირველადი და გადაუდებელი სამედიცინო დახმარების პრიორიტეტულობა, მასში სახელმწიფო და კერძო სექტორების თანამონაწილეობა;
11. სახელმწიფო პასუხისმგებლობა სამედიცინო პერსონალის, ჯანმრთელობის დაცვის დაწესებულებებისა და სამედიცინო სასწავლებლების, აგრეთვე, სამედიცინო - საგანმანათლებლო დაწესებულებების ლიცენზირებისათვის;
12. სახელმწიფოს, საზოგადოების, თითოეული მოქალაქის მონაწილეობა ცხოვრების ჯანსაღი წესის დამკვიდრებისათვის, საცხოვრებელი, სამუშაო და დასასვენებელი გარემოს დაცვისათვის;
13. სამედიცინო მომსახურების სფეროში საკუთრების და ორგანიზაციულ - სამართლებრივი ფორმების მრავალფეროვნება და მათი თანაბარუფლებიანი თანაარსებობა;
14. მოსახლეობის ჯანმრთელობისათვის მავნე ქმედებისათვის კანონმდებლობით განსაზღვრული ეკონომიკური და ადმინისტრაციული სანქციების გატარება;
15. სახელმწიფოს მიერ ჯანმრთელობის დაცვის დაფინანსება პროგრამული და მიზნობრივ-პროგრამული წესით, სახელმწიფო სექტორის ჯანმრთელობის დაცვის დაწესებულებების ფინანსური, სამეურნეო, სახელშეკრულებო ურთიერთობების უზრუნველსაყოფად;
16. სახელმწიფოს მიერ, არსებული რესურსების შესაბამისად, სამედიცინო - ბიოლოგიური და ჯანმრთელობის დაცვის კვლევების დაფინანსება, ხელსაყრელი პირობების შექმნა ამ მიზნით კერძო სექტორიდან სახსრების მოსაზიდად;
17. პროფესიული ასოციაციების, აკადემიების, აგრეთვე, სხვა არასამთავრობო ორგანიზაციების მონაწილეობა ჯანმრთელობის დაცვის თანამედროვე, ეფექტური სისტემის ჩამოყალიბებაში, კონსულტაციების, სამეცნიერო და პროფესიული განხილვების, სათანადო პროექტების შემუშავების, ასევე, სამედიცინო მომსახურების, მედიკამენტების, სამედიცინო დანიშნულების საგნებისა და სამედიცინო ტექნიკური ნაკეთობების წარმოების დაფინანსებაში, პაციენტის უფლებების დაცვაში მონაწილეობის გზით.
„ჯანმრთელობის დაცვის შესახებ“ კანონში განსაზღვრულია ჯანდაცვის სისტემაში საქმიანობის ფორმები და პასუხისმგებლობის საკითხები. ჩვენს სამაგიდო კვლევაში წარმოდგენილია კანონის ზოგადი მიმოხილვა, ხოლო ზოგიერთი საკითხი დეტალურად არის გაშუქებული.
მოქალაქეთა უფლებები ჯანმრთელობის დაცვის სფეროში
წინამდებარე კანონის ძალით საქართველოს მოქალაქეებს უფლება აქვთ, ისარგებლონ დადგენილი წესით დამტკიცებული ჯანმრთელობის დაცვის სახელმწიფო პროგრამით გათვალისწინებული სამედიცინო დახმარებით. აღნიშნული განხორციელდება სათანადო სამედიცინო საქმიანობის სამართალსუბიექტის მიერ, განურჩევლად საკუთრებისა და ორგანიზაციულ - სამართლებრივი ფორმისა.
არ დაიშვება პაციენტის დისკრიმინაცია რასის, კანის ფერის, ენის, სქესის, აღმსარებლობის, პოლიტიკური და სხვა შეხედულებების, ეროვნული, ეთნიკური და სოციალური კუთვნილების, წარმოშობის, ქონებრივი და წოდებრივი მდგომარეობის, საცხოვრებელი ადგილის, დაავადების, სექსუალური ორიენტაციის ან პირადი უარყოფითი განწყობის გამო. არ დაიშვება წინასწარ პატიმრობაში და სასჯელის აღსრულების დაწესებულებაში მყოფი პაციენტის დისკრიმინაცია.
სამკურნალო, სადიაგნოზო, სარეაბილიტაციო, საპროფილაქტიკო პროცესებში პაციენტის მონაწილეობის აუცილებელი პირობაა ზეპირი, ან წერილობითი ინფორმირებული თანხმობა. სამედიცინო ჩარევების ჩამონათვალი, რომელთა ჩატარებისათვის აუცილებელია წერილობითი თანხმობა, განისაზღვრება საქართველოს კანონმდებლობით.
სამედიცინო კვლევაში მონაწილე ავადმყოფის და ჯანმრთელი მოხალისის უფლებები დაცულია საქართველოს კანონმდებლობით და ადამიანზე ბიოსამედიცინო გამოკვლევების ჩატარების აღიარებული საერთაშორისო ნორმებით.
სამედიცინო განათლების პროცესში პაციენტის მონაწილეობის აუცილებელი პირობაა ზეპირი ინფორმირებული თანხმობა.
ქმედუნარიან პაციენტს უფლება აქვს, უარი თქვას ნებისმიერ სამედიცინო ჩარევაზე, გარდა საქართველოს კანონმდებლობით და „ჯანრთელობის დაცვის შესახებ“ კანონის 75-ე მუხლით გათვალისწინებული შემთხვევებისა, აგრეთვე, უარი თქვას სამეცნიერო კვლევებში, ან სამედიცინო განათლების პროცესში მონაწილეობაზე. („ჯანმრთელობის დაცვის შესახებ“ კანონი, მუხლი 75 - სახელმწიფო, საქართველოს ჯანმრთელობისა და სოციალური დაცვის სამინისტროს მიერ შემუშავებული რეკომენდაციების საფუძველზე, ხელმძღვანელობს: ა) სავალდებულო აცრებსა და საკარანტინო ღონისძიებებს; ბ) სათანადო სამკურნალო, პროფილაქტიკურ ღონისძიებებს გადამდები დაავადებების განვითარების მაღალი რისკის მქონე მოქალაქეთათვის; გ) სხვადასხვა ობიექტების ინფიცირებისაგან დაცვას და ინფიცირებული ობიექტების გაუვნებლებას; დ) ეპიდსაწინააღმდეგო ვითარებაში ბრძოლას გადამტანების წინააღმდეგ; ე) სამედიცინო პერსონალის ეპიდემიოლოგიური მზადყოფნისათვის საჭირო ღონისძიებების განხორციელებას).
ყველა ქმედუნარიან პირს უფლება აქვს, წინასწარ წერილობით გამოხატოს, ნება განუკურნებელი დაავადების ტერმინალურ სტადიაში აღმოჩენის შემთხვევაში, მისთვის სარეანიმაციო, სიცოცხლის შემანარჩუნებელი ან პალიატიური მკურნალობის ჩატარების შესახებ.
ქმედუუნარო ან გაცნობიერებული გადაწყვეტილების უნარს მოკლებული პაციენტისათვის სამედიცინო ჩარევის განხორციელება, მისი ჩართვა სამედიცინო განათლებისა და სამეცნიერო კვლევის პროცესში დასაშვებია მხოლოდ მისი წინასწარ გაცხადებული ნების (როცა მას გაცნობიერებული გადაწყვეტილების მიღების უნარი ჰქონდა) გათვალისწინებით, ხოლო ამ უკანასკნელის არარსებობისას - მისი ნათესავის ან კანონიერი წარმომადგენლის ინფორმირებული თანხმობით.
ქმედუუნარო და გაცნობიერებული გადაწყვეტილების მიღების უნარს მოკლებული პაციენტისათვის, გადაუდებელი დახმარების აუცილებლობის ან სიცოცხლისათვის საშიში მდგომარეობის დროს, სამედიცინო ჩარევის შესახებ გადაწყვეტილება მიიღება მხოლოდ პაციენტის ინტერესების გათვალისწინებით.
წინასწარ პატიმრობაში ან სასჯელის აღსრულების დაწესებულებაში მყოფი პირისათვის სამედიცინო დახმარება, მათ შორის შიმშილობის დროს, დასაშვებია მხოლოდ მისი ინფორმირებული თანხმობის შემთხვევაში.
პაციენტს უფლება აქვს, აირჩიოს ან შეიცვალოს სამედიცინო პერსონალი და/ან სამედიცინო დაწესებულება, სადაზღვევო კონტრაქტის პირობების გათვალისწინებით. კონტრაქტი არჩევანის შესაძლებლობას უნდა იძლეოდეს.
ჯანმრთელობის დაცვის სისტემის მართვა, ორგანიზაციის და დაფინანსების საკითხები
დღეისათვის, სახელმწიფოს მხრიდან, ჯანმრთელობის დაცვის სფეროს მართვის მექანიზმები განსაზღვრულია შემდეგნაირად:
- სამედიცინო პერსონალის სერტიფიცირება;
- სამედიცინო დაწესებულების ლიცენზირება;
- სამედიცინო დახმარების ხარისხის კონტროლი;
- სახელმწიფო სანიტარიული ზედამხედველობა და ჰიგიენური ნორმირება;
- სამკურნალო საშუალებების ხარისხის კონტროლი, ფარმაციისა და ფასწარმოების მოწესრიგება;
- ახალი სამკურნალო საშუალებებისა და სამედიცინო ტექნოლოგიების დანერგვისათვის ხელშეწყობა;
- პაციენტსა და სამედიცინო საქმიანობის სამართალსუბიექტს შორის ურთიერთობის სამართლებრივი უზრუნველყოფა;
- ცხოვრების ჯანსაღი წესის დანერგვის ხელშეწყობა;
- სამედიცინო პროგრამების შემუშავება და განხორციელება;
- სამედიცინო მეცნიერების განვითარების ხელშეწყობა;
- ქვეყნის ტერიტოტიაზე ეპიდემიოლოგიური კონტროლის განხორციელება;
- საზოგადოებრივი ჯანმრთელობის დაცვის სფეროს განვითარებისათვის ხელშეწყობა სათანადო ინსტიტუციონალური მოწყობისა და სახელმწიფო სამედიცინო პროგრამების განხორციელების გზით.
წინამდებარე კანონით განსაზღვრულია, რომ მოსახლეობის სამედიცინო დაზღვევის რეგულირება ხორციელდება კანონით „სამედიცინო დაზღვევის შესახებ“.
ასევე, უნდა აღინიშნოს, რომ ჯანმრთელობის დაცვის სახელმწიფო
დაფინანსების ძირითადი ფორმაა პროგრამული და მიზნობრივ-პროგრამული
დაფინანსება.
სამედიცინო და ფარმაცევტული პერსონალის სერტიფიცირება
სამედიცინო და ფარმაცევტული პერსონალის სერტიფიცირება არის ერთ-ერთი მნიშვნელოვანი ინსტიტუტი, რითაც სახელმწიფოს შესწევს უნარი (ძალა), კონტროლს დაუქვემდებაროს მოსახლეობისადმი მედიცინის მუშაკების მიერ გაწეული მომსახურება.
სერტიფიკატი არის სამედიცინო და ფარმაცევტული პერსონალის პროფესიული ცოდნისა და პრაქტიკული უნარ-ჩვევების დონის შეფასება მედიცინისა და ფარმაციის ცალკეულ სპეციალობებში, რაც უნიფიცირებული სახელმწიფო სასერტიფიკაციო გამოცდის მეშვეობით ხორციელდება.
სამედიცინო და ფარმაცევტული პერსონალის სერტიფიკაციას, განმეორებით სერტიფიკაციას წარმართავს სახელმწიფო სერტიფიკატის მიმნიჭებელი საბჭო. პერსონალის სერტიფიცირების სისტემა არის ერთ-ერთი მინიმალური გარანტია დაწესებულებაში წარმოებული მომსახურებისა. ამდენად ამ სისტემის მაქსიმალური დახვეწა არის ძალზე მნიშვნელოვანი. ამ საკითხის რეგულირებისათვის დამტკიცებულია შორმის, ჯანმრთელობისა და სოციალური დაცვის მინისტრის №193/ნ (2000 წლის 9 ნეომბერი) ბრძანება „სამედიცინო და ფარმაცევტული პერსონალისათვის სახელმწიფო სერტიფიკატის მინიჭების შესახებ“. ამ ბრძანებაში ცვლილებები განხორციელდა 2002 წლის №85/ნ ნორმატიული აქტით. (სამედიცინო და ფარმაცევტული პერსონალის სერტიფიკაცია - დანართი 1).
სამედიცინო საქმიანობა
ამ თავში განსაზღვრულია სამედიცინო საქმიანობის უფლების მქონე სპეციალისტების (ექიმი, ექთანი და სხვა) ფუნქციები და მოვალეობები, თვით ექსტრემალური ვითარების დროს.
- დამოუკიდებელი პრაქტიკული სამედიცინო საქმიანობის უფლება აქვს მხოლოდ სათანადო, სახელმწიფო სერტიფიკატით დამოწმებული სამედიცინო საგანმანათლებლო ცენზის მქონე სპეციალისტს (ექიმი, ექთანი და სხვა).
- საქართველოს მოქალაქეებს, სხვა ქვეყნის მოქალაქეებს, რომელთაც სამედიცინო განათლება ან დამოუკიდებელი სამედიცინო საქმიანობის უფლება საზღვარგარეთ მიიღეს, საქართველოში დამოუკიდებელი პრაქტიკული სამედიცინო საქმიანობის რეალიზაცია მხოლოდ შესაბამისი სერტიფიკატის მიღების შემთხვევაში შეუძლიათ.
სამედიცინო დაწესებულება
1. „ჯანმრთელობის დაცვის შესახებ“ კანონით განსაზღვრულია, რომ სამედიცინო დაწესებულება არის საქართველოს კანონმდებლობით დაშვებული ორგანიზაციულ-სამართლებრივი ფორმის იურიდიული პირი, რომელიც დადგენილი წესით ახორციელებს სამედიცინო საქმიანობას. სამედიცინო დაწესებულების ფინანსურ რესურსებში სამედიცინო საქმიანობიდან მიღებული ნაწილი შეადგენს არანაკლებ 75%-ს, ხოლო მის ბალანსზე არსებული ძირითადი ფონდების საშუალო წლიური ღირებულების არანაკლებ 75%-ისა დაკავებულია მე-2 პუნქტში ჩამოთვლილი ფუნქციებით.
2. სამედიცინო დაწესებულების ფუნქციაა:
ა) პაციენტის ჯანმრთელობის მდგომარეობის განსაზღვრა;
ბ) დაავადებათა პროფილაქტიკა და/ან მკურნალობა და/ან პაციენტის რეაბილიტაცია;
გ) სამეანო საქმიანობა;
დ) ფარმაცევტული საქმიანობა;
ე) სახელმწიფო სანიტარიული ზედამხედველობა და ჰიგიენური ნორმირება;
ვ) გვამის პათოლოგიურ-ანატომიური გამოკვლევა, სასამართლო სამედიცინო ექსპერტიზა.
ასევე გასათვალისწინებელია, რომ წინა წელთან შედარებით შიდა სტანდარტებით შესრულებული სამედიცინო მომსახურებით და სხვა ეკონომიკური საქმიანობით მიღებული შემოსავლის 100% რჩება სამედიცინო დაწესებულების განკარგულებაში, რომლის განაწილებას ეკონომიკური კლასიფიკატორის მიხედვით, როგორც წესი, ახდენს დაწესებულების ხელმძღვანელი სამეთვალყურეო საბჭოსთან შეთანხმებით, ამასთან, შრომის ანაზღაურების ფონდი უნდა შეადგენდეს შემოსავლის არანაკლებ 30%.
სამედიცინო დაწესებულების თავში განხილულია სამედიცინო დაწესებულების ლიცენზირების საკითხები, კერძოდ აღნიშნულია, რომ სამედიცინო დაწესებულების სამედიცინო საქმიანობის უფლების დამადასტურებელ დოკუმენტს შეადგენს ლიცენზია, რომელსაც გასცემს შრომის, ჯანმრთელობისა და სოციალური დაცვის სამინისტრო.
ამ თავში ასევე განხილულია ლიცენზიის გაუქმების საკითხები, რაც შესაბამობაში არ მოდის „სამეწარმეო საქმიანობის ლიცენზიისა და ნებართვის გაცემის საფუძვლების შესახებ“ კანონთან და „სამედიცინო და ფარმაცევტული საქმიანობის ლიცენზირების შესახებ“ კანონთან, რადგან „ჯანმრთელობის დაცვის შესახებ“ კანონით განსაზღვრულია, რომ (55-ე მუხლი):
1. სამედიცინო საქმიანობის სამართალსუბიექტის ლიცენზია უქმდება, თუ სამედიცინო დაწესებულება:
ა) არ აკმაყოფილებას გაცემული ლიცენზიის პირობებს;
ბ) მისი საქმიანობა სცილდება ლიცენზიით განსაზღვრულ ფარგლებს;
გ) შესაბამის ორგანოებს დადგენილი წესით არ აწვდის სამედიცინო სტატისტიკურ ინფორმაციას;
დ) ლიცენზიის მიღებიდან 6 თვის განმავლობაში არ ახორციელებს ლიცენზიით განსაზღვრულ საქმიანობას;
ე) არ ასრულებს ეპიდემიოლოგიური კონტროლის აუცილებელ ღონისძიებებს.
2. სამედიცინო საქმიანობის ლიცენზიის გაუქმების შესახებ გადაწყვეტილება შეიძლება გასაჩივრდეს სასამართლოში.
„სამედიცინო და ფარმაცევტული საქმიანობის ლიცენზირების შესახებ“ კანონი მიღებულია უფრო გვიან, რის გამოც წინამდებარე დებულებები ვერ იმოქმედებენ ლიცენზიის გაუქმებისას. ამდენად „ჯანმრთელობის დაცვის შესახებ“ კანონიდან ეს მუხლი უნდა იქნას ამოღებული.
სამედიცინო დაწესებულება შეიძლება იყოს სამეწარმეო, ან არასამეწარმეო იურიდიული პირი. სამედიცინო დაწესებეულება, კანონმდებლობით განსაზღვრული წესით, სარგებლობს პროფესიული და საფინანსო დამოუკიდებლობით.
სამედიცინო პერსონალის შრომის ანაზღაურება ნარდობრივია. მისი ოდენობა და პირობები განისაზღვრება: ა) ცალკეულ სპეციალობაში მაქსიმალური დატვირთვის ნორმატივით, რასაც დადგენილი წესით ამტკიცებს საქართველოს შრომის, ჯანმრთელობისა და სოციალური დაცვის სამინისტრო; ბ) შრომის ხელშეკრულებით (კონტრაქტით) სამედიცინო დაწესებულებასა და ცალკეულ მუშაკს შორის.
გარდა ზემოთ განხილული თავებისა, „ჯანმრთელობის დაცვის შესახებ“ კანონი განსაზღვრავს და, შესაბამისად, არეგულირებს შემდეგ საკითხებს:
სამედიცინო ტექნიკური ნაკეთობები და სამედიცინო ტექნოლოგიები;
მოსახლეობის ფსიქიკური ჯანმრთელობა;
სახელმწიფო სანიტარიული ზედამხედველობა და ჰიგიენური ნორმირება;
დაავადებათა კონტროლი;
სოციალურად საშიში დაავადებები და დაავადებები, რომლებიც საჭიროებს მუდმივ ჩანაცვლებით მკურნალობას;
მოსახლეობის ჯანმრთელობის დაცვა თამბაქოს და ალკოჰოლის ჭარბი მოხმარებისგან, ნებადართული პრეპარატების არასწორი გამოყენებისა და აკრძალული პრეპარატების მოხმარების მავნე ზეგავლენისაგან;
ჯანმრთელობის ხელშეწყობა;
მოქალაქეთა ჯანმრთელობის დაცვა საგანგებო მდგომარეობის _ სტიქიური უბედურებების და ტექნიკური კატასტროფის დროს;
პროფესიული დაავადებები;
სამედიცინო განათლება;
სამედიცინო პერსონალისა და სამედიცინო დაწესებულების პროფესიული პასუხისმგებლობა;
სამედიცინო-ბიოლოგიური კვლევა;
ადამიანის ორგანოების, ორგანოთა ნაწილების, ქსოვილების აღება და გამოყენება;
სისხლისა და სისხლის კომპონენტების დონორობა;
უსაფრთხო დედობა და ბავშვთა ჯანმრთელობის დაცვა;
ოჯახის დაგეგმვა;
კრიტიკული მდგომარეობა, სიკვდილი და ევთანაზია.
„წამლისა და ფარმაცევტული საქმიანობის შესახებ“ კანონის მიმოხილვა
„წამლისა და ფარმაცევტული საქმიანობის შესახებ“ კანონი არეგულირებს სამკურნალო საშ უალებების ბრუნვის განმახორციელებელ სუბიექტთა საქმიანობისა და ამ სფეროში მართლზომიერების სახელმწიფო გარანტიის სამართლებრივ საფუძველს.
ამ კანონის მიზანია:
შექმნას ხარისხიანი, უსაფრთხო და ეფექტური წამლებით მოსახლეობის უზრუნველყოფის საფუძველი;
დაარეგულიროს წამლის მიმოქცევისა და გამოყენების სფეროში დასაქმებული ფიზიკური და იურიდიული პირების საქმიანობა;
განსაზღვროს:
- სპეციალისტთა და ფარმაცევტული დაწესებულებების თანამდებობის პირთა უფლებები და პასუხისმგებლობა;
- სამკურნალო საშუალებების მიმოქცევის მართვის სფეროში დასაქმებული სახელმწიფო ორგანოებისა და დაწესებულებების უფლება-მოვალეობები;
- სამკურნალო საშუალებების მიმოქცევის სხვა სუბიექტების საქმიანობის რეგულირების პრინციპები.
შრომის, ჯანმრთელობისა და სოციალური დაცვის სამინისტრო განსაზღვრავს სამკურნალო საშუალებების გამცემი ჯანმრთელობის დაცვის სახელმწიფო დაწესებულებებით მოსახლეობის მინიმალური უზრუნველყოფის ნორმატივებს (თუმცა, უნდა აღინიშნოს, რომ ასეთი ნორმატივები არ არსებობს).
სამკურნალო საშუალებების მიმოქცევის სფეროში სახელმწიფო მართვას ახორციელებს შრომის, ჯანმრთელობისა და სოციალური დაცვის სამინისტრო. მისი ძირითადი ფუნქციებია:
სამკურნალო საშუალებების მიმოქცევის სფეროში სახელმწიფო პოლიტიკის შემუშავებაში მონაწილეობა და მოქმედი კანონმდებლობის ფარგლებში ფარმაცევტული საქმიანობის კოორდინაცია;
ფარმაცევტული საქმიანობის ინსპექტირება;
ფარმაცევტული კადრების მომზადებისა და უწყვეტი განათლების სისტემაში მონაწილეობა;
ფარმაციის სპეციალისტების (ფარმაცევტი და ფარცავტის თანაშემწე) სერტიფიკაცია;
სამკურნალო საშუალების ექსპერტიზის ორგანიზება და სამკურნალო საშუალების სახელმწიფო რაგისტრაცია;
ფარმაცევტული დაწესებულების ლიცენზირება;
სამკურნალო საშუალების ხარისხის სახელმწიფო კონტროლი;
სამკურნალო საშუალებების შესახებ ინფორმაციისა და სამკურნალო საშუალებების რეკლამის კონტროლი;
სამკურნალო საშუალებებზე ფასწარმოქმნის სახელმწიფო რაგულირებაში მონაწილეობა;
ფარმაცევტული დაწესებულებების ფუნქციონირების სავალდებულო ნორმებისა და მოთხოვნების დანუშავება, დამტკიცება და მათი საქმიაობის მალეგულირებელი სამართლებრივი აქტებისა და ანალიზური ინფორმაციის გამოცემა;
პროფესიულ გაერთიანებებთან თანამშრომლობა.
კანონში განხილულია სამკურნალო საშუალებების შექმნისა და ფარმაკოლოგიური კვლევის საკითხები. ეს თავი, თავის მხრივ, მოიცავს ფარმაკოლოგიური საშუალებების კლინიკამდელი კვლევისა და კლინიკური კვლევის საკითხებს, თუ როგორი პროცედურით უნდა განხორციელდეს იგი. ასევე განხილულია კლინიკური კვლევის სუბიექტის უფლებების დაცვისა და სამკურნალო საშუალებების ხარისხის უზრუნველყოფის სისტემა, თუ როგორ უნდა განხორციელდეს იგი.
წამლის რეგისტრაცია
„წამლისა და ფარმაცევტული საქმიანობის შესახებ“ კანონი არეგულირებს წამლის სახელმწიფო რეგისტრაციის წესსა და პირობებს.
გასათვალისწინებელია, რომ წამლის რეგისტრაცია თავისი ბუნებითა და ფორმით ემსგავსება ნებართვსის გაცემას, თუმცა ის განსხვავებული პროცედურებით საეგებლობს. საქართველოს ტერიტორიაზე ნებადართულია მხოლოდ რეგისტრირებული სამკურნალო საშუალების გაცემა-გამოყენება, გარდა კანონით დადგენილი გამონაკლისებისა.
სამკუნალო საშუალების სახელმწიფო რაგისტრაციას ახორციელებს საქართველოს შრომის, ჯანმრთელობისა და სოციელური დაცვის სამინისტრო. სამკურნალო საშუალების რეგისტრაციის თაობაზე წარმოდგენილი განახადი შეიცავს ინფორმაციას მწარმოებლის ან რეგისტრაციის უფლების მქონე სხავა სუბიექტის შესახებ, აგრეთვე სამკურნაო საშუალების საერთაშორისო არაპეტენტირებული სახელწოდებისა და სავაჭრო დასახელების, სუბსტანციის, სინონიმების, წამლის ფორმის, დოზის, სრული შემადგენლობის, გაცემის პირობების, გამოყენების წესების, შენახვის ვადისა და პირობების, შეფუთვის თაობაზე.
სამკურნალო საშუალების რეგისტრაციის თაობაზე წარდგენილ განაცხადს თან ერთვის:
სამკურნალო საშუალების ხარისხის სერთიფიკატი;
მასალები კლინიკამდელი, შეასაბამისი კვლევის შედეგების შესახებ;
ფარმაკოპეის სტატია ან ფარმაკოპეის სტატიის საწყისი ტექსტი;
სამკურნალო საშუალებების ხარისხის კონტროლის მეთოდების აღწერილობა;
ცხოველთა მკურნალობისთვის განკუთვნილი სამკურნალო საშუალების რეგისტრაციისას - ვეტერინარული კვლევის შედეგები;
სამკურნალო საშუალების ნიმუშები - ხარისხის ექსპერტიზის ჩასატარებლად;
სამკურნალო საშუალების რეგისტრაციის დამადასტურებელი დოკუმენტები, თუ იგი რეგისტრირებულია საქართველოს გარეთ;
სარეგისტრაციო მოსაკრებლის გადახდის დამადასტურებელი დოკუმენტი.
სამინისტრო მასალების წარდგენიდან არა უგვიანეს 4 თვისა იღებს გადაწყვეტილებას სამკურნალო საშუალების რეგისტრაციის ან მის რეგისტრაციაზე უარის თქმის შესახებ (სამკურნალო საშუალებების რეგისტრაციის წესი - დანართი 2).
გასათვალისწინებელია, რომ გარკვეული სახის პროდუქციაზე, რომელთა სამკურნალო საშუალებებად ჩათვლა კითხვის ნიშნებს ბადებს, მოქმედებს რეგისტრაციისათვის შეღავათიანი რეჟიმი (ისევე, როგორც საგადასახადო კუთხით).
კერძოდ, სამკურნალო-პროფილაკტიკურ საშუალებებს - კბილის პასტას, საღეჭ რეზინას, კოსმეტიკურ და ჰიგიენურ საშუალებებს - რეგისტრაციისას, თუ ისინი იდენტურია ორიგინალური სამკურნალო-პროფილაკტიკური საშუალებების მწარმოებლის მიერ საქართველოში ადრე რეგისტრირებული საშუალებებისა და წარმოებულია სხვა ქვეყანაში ამ მწარმოებლის მიერ გაცემული ლიცენზიის საფუძველზე, დაჩქარებული რეგისტრაციის პროცედურით ენიჭება საქართველოში ადრე რეგისტრირებული სამკურნალო-პროფილაკტიკური საშუალებების სტატუსი.
გენერიკული მედიკამენტის, საქართველოში უკვე რეგისტრირებული ორიგინალური სამკურნალო საშუალების ანალოგიური საშუალების, რომელიც წარმოებულია განახლებული ტექნოლოგიით ან დამხმარე ნივთიერებათა სხვა შემადგენლობით, გრეთვე ჰუმანიტარული მიზნით შემოტანილი სამკურნალო საშუალების სახელმწიფო რეგისტრაციისათვის სამინისტრო იყენებს რეგისტრაციის გამარტივებულ (დაჩქარებულ პროცედურას). გამარტივებული პროცედურა ნიშნავს სამკურნალო საშუალების ხარისხის, ეფექტიანობისა და უსაფრთხოობის მიმართ მოთხოვნების შეცვლას.
საქართველოს სამკურნალო საშუალებების სახელმწიფო რეესტრში აღინიშნება სამკურნალო საშუალების სავაჭრო დასახელება, დოზა, ფორმა, მწარმოებალი ქვეყანა, მწარმოებელი ან რეგისტრაციის უფლების მქონე სხვა სუბიექტი, საერთაშორისო არაპატენტირებული სახელწოდება, სარეგისტრაციო მოწმობის ნომერი და რეგისტრაციის მოქმედების ვადა.
სამკურნალო საშუალებების მიმოქცევა საქართველოში ნებადართულია მისი სახელმწიფო რეგისტრაციიდან 5 წლის განმავლობაში.
სამკურნალო საშუალებების სახელმწიფო რაგისტრაციაზე უარის შესახებ წერილობით ეცნობება განმცხადებელს გადაწყვეტილების მიღებიდან 15 დღეში;
სამკურნალო საშუალებების საელმწიფო რეგისტრაციას ექვემდებარება:
ა) თერაპიული და დიაგნოსტიკური საშუალებები და მათი წამლის ფორმები;
ბ) ბიოლოგიური სამკურნალო-პროფილაკტიკური და დიაგნისტიკური პრეპარატები;
გ) იმუნობიოლოგიური პრეპარატები;
დ) თერაპიული ეფექტის მქონე საკვები დანამატები;
ე) შიგნით მისაღები, სამედიცინო დანიშნულების რაქტივები და რეაგენტები;
ვ) სტომატოლოგიაში გამოსაყენებელი მასალები;
ზ) კონტრაცეპტიული მექანიკური საშუალებები;
თ) ჰომეოპათიური საშუალებები;
ი) პარასამკურნალო საშუალებები;
კ) ვეტერინარული სამკურნალო საშუალებები;
ლ) სხვა მწარმოებლის მიერ წარმოებული, საქართველოში უკვე რეგისტრირებულის ანალოგიური სამკურნალო საშუალებები;
მ) ხელახალ რეგისტრაციას დაქვემდებარებული სამკურნალო საშუალებები.
გასათვალისწინებელია, რომ ფარმაცევტული სუბსტანცია, დაუფასოებელი შუალედური ფარმაცევტული პროდუქტი, მაგისტრალური და ოფიცინალური რეცეპტებით აფთიაქში მომზადებული წამლების რეგისტრაციას არ ექვემდებარება.
წამლის კომპონენტებთან, თერაპიულ ჩვენებასთან, ფორმასთან, დოზასთან, გამოყენების მეთოდთან, ვარგისიანობის ვადასთან, პირველად შეფუთვასთან, სტანდარტებთან და წარმოების ტექნოლოგიასთან დაკავშირებული ცვლილებების შემთხვევებში ხორციელდება ხელახალი რეგისტრაცია. ყველა სხვა ცვლილება საჭიროებს მხოლოდ საქართველოს შრომის, ჯანმრთელობისა და სოციალური დაცვის სამინისტროსათვის სავალდებულო შეტყობინებას, კერძოდ, რეგისტრაციის უფლების მქონე სუბიექტის მიერ სათანადო დასაბუთებული ინფორმაციის წარდგენას; სამინისტროს უფლება აქვს შეტყობინების მიღებიდან არა უგვიანეს 20 დღისა არგუმენტირებულად უარყოს მასში მითითებული ცვლილება.
სამინისტრო აუქმებს ან დროებით, რეგისტრაციის შეჩერების მიზეზის აღმოფხვრამდე აჩერებს საქართველოში სამკურნალო საშუალებების რეგისტრაციას, თუ:
ა) სამკურნალო საშუალებას აღმოაჩნდა ადამიანისათვის (ცხოველისთვის) ან მისი შთამომავლობისთვის ზიანის მომტანი თვისება;
ბ) სარეგისტრაციო დოკუმენტაციით წარმოდგენილ ინფორმაციაში შეტანილ იქნა რაიმე ცვლილება, რომელიც დადგენილი წესითა და ფორმით არ არის შეთანხმებული შრომის, ჯანმრთელობისა და სოციალური დაცვის სამინისტროსთან.
როგორც ზემოთ აღვნიშნეთ, კანონით წინასწარ განსაზღვრულ განსაკუთრებულ შემთხვევებში დაშვებულია არარეგისტრირებული სამკურნალო საშუალებების საქართველოს ტერიტორიაზე შემოტანა, კერძოდ:
ა) კლინიკამდელი და კლინიკური კვლევისათვის;
ბ) სახელმწიფო რეგისტრაციისათვის - ნიმუშის სახით;
გ) ფიზიკური პირის ინდივიდუალური საჭიროებისათვის;
დ) საერთაშორისო მიმართულებაზე მომუშავე სატრანსპორტო საშუალების ბრიგადის მიერ მგზავრთა სამედიცინო დახმარებისათვის საჭირო ოდენობით;
ე) გამოფენების, სიმპოზიუმების, კონფერენციების, ფორუმებისა და კონგრესებისათვის - ნიმუშის სახით, რეალიზაციის უფლების გარეშე;
ვ) რეექსპორტისათვის.
განსაკუთრებულ პირობებში (სტიქიური უბედურება, მოსახლეობის მასობრივი დაზიანება, ეპიდემია, იშვიათი დაავედება) ან გადაუდებელი სახელმწიფო ინტერესების არსებობის შემთხვევაში საუწყებათაშორისო კომისიის გადაწყვეტილებით დასაშვებია საქართველოში არარეგისტრირებული სამკურნალო საშუალებების საქართველოს ტერიტორიაზე შემოტანა და გამოყენება, თუ წარმოდგენელია საზღვარგარეთის ქვეყანებში მათი რეგისტრაციისა და გამოყენების დამადასტურებელი დოკუმენტები.
აკრძალულია საქართველოში რეგისტრირებული სამკურნალო საშუალების უკანონო ასლის, ფალსიფიცირებული სამკურნალო საშუალების საქართველოს ტერიტორიაზე შემოტანა.
ასევე ცალკე არის განსაზღვრული საქართველოს ტერიტორიაზე სამკურნალო საშუალებების ჰუმანიტარული მიზნით შემოტანილი პროდუქციის წესი, რომელიც დამტკიცებულია სამინისტროს მიერ.
უფრო მეტი სიზუსტისათვის, კანონში მკაფიოდ არის გაწერილი იმ მეწარმეთა უფლება ვინც უფლებამოსილია განახორციელოს საქართველოს ტერიტორიაზე სამკურნალო საშუალებების შემოტანა. ესენია:
ა) შესაბამისი საქმიანობაზე ლიცენზიის მქონე იურიდიული პირი;
ბ) სამეცნიერო-კვლევითი დაწესებულება - წამლის შექმნის ტექნოლოგიის შემუშავების, მისი ხარისხის, ეფექტიანობისა და უსაფრთხოების გამოკვლევის მიზნით.
სარეგისტრაციო მოსაკრებელი
„სარეგისტრაციო მოსაკრებლების შესახებ“ კანონით დადგენილია კონრეტული თანხა სამედიცინო და ვეტერინარული პროდუქციის რეგისტრაციაზე, რომელსაც ახორციელებს შრომის, ჯანმრთელობისა და სოციალური დაცვის სამინისტრო (სარეგისტრაციო მოსაკრებლები - დანართი 3).
რეგისტრაციისათვის განმცხადებელი ვალდებულია გადაიხადოს კანონით დაწესებული სარეგისტრაციო მოსაკრებელი, რომლის გადახდევინება ხორციელდება რეგისტრაციამდე, ნაღდი ან უნაღდო ანგარიშსწორებით. რეგისტრაციის მაძიებელი სარეგისტრაციო მოსაკრბელის გადახდის დამადასტურებელ ქვითარს კანონმდებლობით დადგენილ სხვა საბუთებთან ერთად წარუდგენს სამინისტროს. ზედმეტად გადახდილი თანხა რეგისტრაციის მაძიებელს უბრუნდება სარეგისტრაციო ორგანოს მიერ მისი წერილობითი განცხადების მიღებიდან 20 დღის ვადაში.
სამკურნალო საშუალებების წარმოება
სამკურნალო საშუალებების წარმოება ემყარება სათანადო საწარმოო სტანდარტს, რომელსაც საერთაშორისო ნორმების საფუძველზე შეიმუშავებს და ამტკიცებს საქართველოს შრომის, ჯანმრთელობისა და სოციალური დაცვის სამინისტრო.
სამკურნალო საშუალებებს აწარმოებს ფარმაცევტული საწარმო სამინისტროს მიერ გაცემული ლიცენზიის საფუძველზე. ფარმაცევტული საწარმოს მიერ გამოშვებული პროდუქციის ხარისხზე პასუხს აგებენ საწარმოს ხელმძღვანელი და მის მიერ გამოყოფილი პასუხისმგებელი პირები.
დღევანდელი კანონმდებლობით სამკურნალო საშუალებების მარკირება ხორციელდება „კაფიო და არაჩამორეცხვადი შრიფტით, საქართველოს მოსახლეობისათვის გასაგებ ენაზე. წამლისა და ფარმაცევტული საქმიანობის შესახებ“ კანონში დეტალურად არის მოცემული ის ინფორმაცია, რომელიც უნდა განთავსდეს სამკურნალო საშუალებების პირველად და მეორად შეფუთვაზე.
საქართველოს ტერიტორიაზე მიმოქცევაში არსებულ წამალს თან უნდა ახლდეს სახელმწიფო ენაზე წარმოდგენილი ინქტსურქცია, რომლის ტექსტს ამტკიცებს შრომის, ჯანმრთელობისა და სოციალური დაცვის სამინისტრო.
საქართველოს ტერიტორიაზე წარმოებული და მიმოქცევაში არსებული ყველა სამკურნალო საშუალება ექვემდებარება სახელმწიფო კონტროლს, რომელსაც ახორციელებს შრომის, ჯანრთელობისა და სოციალური დაცვის სამინისტრო.
სამკურნალო საშუალებების ხარისხის შერჩევითი სახელმწიფო კონტროლის განხორციელებას აფინანსებს სამინისტრო სახელმწიფო ბიუჯეტიდან მისთვის გამოყოფილი ასიგნებების ფარგლებში. ეს ჩანაწერი არის საკმაოდ კარგი და დამცავი მექანიზმი მეწარმეთათვის, თუმცა რეალურად ამ ჩანაწერს სჭირდება სპეციალური პროგრამული დაფინანსება, რომელიც აუცილებლად ცალკე მუხლად უნდა იქნას გაწერილი სახელმწიფო ბიუჯეტში.
 |
3 სამედიცინო და ფარმაცევტული საქმიანობის ლიცენზირება შესავალი |
▲back to top |
II თავი
სამედიცინო და ფარმაცევტული საქმიანობის განხორციელებისათვის აუცილებელია, რომ შესაბამის დაწესებულებას გააჩნდეს საქართველოს შრომის, ჯანმრთელობისა და სოციალური დაცვის სამინისტროს მიერ გაცემული ლიცენზია.
ლიცენზირებას არ ექვემდებარება ფიზიკური პირის (გარდა ინდ. მეწარმესი) საექიმო საქმიანობა.
სამკურნალო საშუალებების, ფარმაცევტული სუბსტანციებისა და დაუფასოებელი ფარმაცევტული პროდუქციის იმპორტისა და რეექსპორტის, სპეციალურ კონტროლს დაქვემდებარებული სამკურნალო საშუალებების იმპორტის და ექსპორტის შემთხვევაში აუცილებელია მეწარმეს ჰქონდეს სამინისტროს მიერ გაცემული ნებართვა პროდუქციის სახეობის მიხედვით.
ტერმინთა განმარტება
ანგარიშში გამოყენებულ ტერმინებს აქვთ შემდეგი მნიშვნელობა:
ლიცენზია - შრომის, ჯანმრთელობისა და სოციალური დაცვის სამინისტროს მიერ გაცემული დოკუმენტი, რომლის საფუძველზე მეწარმეს უფლება აქვს განახორციელოს სამედიცინო და ფარმაცევტული საქმიანობა. ლიცენზია გაიცემა ერთჯერადად და იგი უვადოა.
ნებართვა - დოკუმენტი, რომლის საფუძველზე მეწარმეს უფლება აქვს აწარმოოს პროდუქციის იმპორტი, ექსპორტი და რეექსპორტი იგი გაიცემა ერთჯერადად კონკრეტული ოპერაციის განხორციელების ვადით.
სალიცენზიო/სანებართვო პირობები - კანონით დადგენილი მოთხოვნების ამომწურავი ნუსხა, რომლის დაცვაც აუცილებელია ლიცენზიის/ნებართვის მისაღებად. აგრეთვე წესების, ნორმებისა და მოთხოვნების ერთობლიობა, რომელთა დაცვაც კანონით მოეთხოვება ლიცენზიის/ნებართვის მფლობელს ლიცენზიით/ნებართვით განსაზღვრული სამეწარმეო საქმიანობის განსახორციელებლად.
სამედიცინო ან ფარმაცევტული დაწესებულების პასპორტი - საქართველოს შრომის, ჯანმრთელობისა და სოციალური დაცვის მინისტრის ნორმატიული აქტით დადგენილი მინიმალური მოთხოვნები (შენობის დახასიათება - ნახაზი, კადრები, აპარატურა, სამუშაოს მოცულობა), რომლებსაც უნდა აკმაყოფილებდეს დაწესებულება კონკრეტულ საქმიანობაზე ლიცენზიის მისაღებად.
სამკურნალო საშუალების რეგისტრაცია - საქართველოში წარმოებული და სხვა ქვეყნიდან შემოტანილი სამკურნალო საშუალებების სახელმწიფო ექსპერტიზის პროცედურა, რომლის საფუძველზეც დაშვებულია სამკურნალო საშუალებების მიმოქცევა საქართველოში. სამკურნალო საშუალების რეგისტრაციის ვადაა 5 წელი.
ხარისხის გარე კონტროლის სისტემა - სამედიცინო დიაგნოსტიკური საქმიანობის ობიექტურობისა და საიმედოობის დადასტურების მიზნით შემუშავებული სისტემა.
ჯანდაცვის სფეროში ლიცენზიასა და ნებართვას შორის არსებობს შემდეგი ძირითადი განსხვავებები:
1. ლიცენზია გაიცემა სამედიცინო და ფარმაცევტულ სფეროში სამეწარმეო საქმიანობაზე, ხოლო ნებართვა - სამკურნალო საშუალებების, ფარმაცევტული სუბსტანციების, დაუფასოებელი ფარმაცევტული პროდუქციის იმპორტისა და რეექსპორტის, სპეციალურ კონტროლს დაქვემდებარებული სამკურნალო საშუალებების იმპორტისა და ექსპორტისათვის;
2. ლიცენზია გაიცემა უვადოდ, ხოლო ნებართვა - ერთჯერადად, კონკრეტული ოპერაციის განხორციელების ვადით.
ლიცენზიისა და ნებართვის სისტემის საკანონმდებლო რეგულირება
ლიცენზიისა და ნებართვის გაცემის ზოგადი წესები და პრინციპები დადგენილია „სამეწარმეო საქმიანობის ლიცენზიისა და ნებართვის გაცემის საფუძვლების შესახებ“ საქართველოს კანონით.
აკრძალულია ლიცენზიისა და ნებართვის შემოღება ისეთ საქმიანობაზე, რომელიც კანონით არ არის გათვალისწინებული;
აკრძალულია კანონქვემდებარე აქტით ისეთი დოკუმენტის მიღება, რომელიც შინაარსობრივად განსაზღვრავს რაიმე საქმიანობაზე სალიცენზიო ან სანებართვო რეჟიმს;
ლიცენზირებას და ნებართვას დაქვემდებარებული კონკრეტული საქმიანობის ჩამონათვალი განისაზღვრება მხოლოდ კანონით;
ლიცენზიის და ნებართვის მისაღებად საჭირო დამატებითი პირობები განისაზღვრება მხოლოდ კანონით.
„სამეწარმეო საქმიანობის ლიცენზიისა და ნებართვის გაცემის საფუძვლების შესახებ“ საქართველოს კანონიდან გამომდინარე მიღებულ იქნა „სამედიცინო და ფარმაცევტული საქმიანობის ლიცენზირების შესახებ“ კანონი, რომლითაც განისაზღვრა სამედიცინო და ფარმაცევტული საქმიანობის სალიცენზიო სახეობები, ხოლო სანებართვო სახეობები და მათ მოსაპოვებლად დადგენილი დამატებითი პირობები განისაზღვრა „წამლისა და ფარმაცევტული საქმიანობის შესახებ“ და „ნარკოტიკული საშუალებების, ფსიქოტროპული ნივთიერებების, პრეკურსორებისა და ნარკოლოგიური დახმარების შესახებ“ კანონებით.
სალიცენზიო სფეროები და მოსაკრებლები
სამედიცინო და ფარმაცევტული საქმიანობის ჩამონათვალი და მოსაკრებლები
სალიცენზიო საქმიანობები განსაზღვრულია „სამეწარმეო საქმიანობის ლიცენზიისა და ნებართვის გაცემის საფუძვლების შესახებ“ და „სამედიცინო და ფარმაცევტული საქმიანობის ლიცენზირების შესახებ“ კანონებით, მოსაკრებლები კი - „სალიცენზიო და სანებართვო მოსაკრებლის შესახებ“ კანონით.
სალიცენზიო სამედიცინო საქმიანობა
№ |
სალიცენზიო საქმიანობა |
მოსაკრებელი (ლარი) |
|
1 |
აივ-დიაგნოსტიკა ლაბორატორიული |
|
40 |
2 |
აივ-ინფექციის/შიდსის მკურნალობა |
ამბულატორიულ-პოლიკლინიკური დახმარება |
40 |
3 |
აივ-ინფექციის/შიდსის მკურნალობა |
სტაციონარული დახმარება |
40 |
4 |
ალერგოლოგია |
მოზრდილთა ამბულატორიულპოლიკლინიკური დახმარება |
20 |
5 |
ალერგოლოგია |
ბავშვთა ამბულატორიული დახმარება |
20 |
6 |
ალერგოლოგია |
მოზრდილთა სტაციონარული დახმარება |
20 |
7 |
ალერგოლოგია |
ბავშვთა სტაციონარული დახმარება |
20 |
8 |
ალკოჰოლური თრობის შემოწმება |
|
100 |
9 |
ანგიოლოგია |
მოზრდილთა ამბულატორიულპოლიკლინიკური დახმარება |
20 |
10 |
ანგიოლოგია |
ბავშვთა ამბულატორიულპოლიკლინიკური დახმარება |
20 |
11 |
ანგიოლოგია |
მოზრდილთა სტაციონარული დახმარება |
20 |
12 |
ანგიოლოგია |
ბავშვთა სტაციონარული დახმარება |
20 |
13 |
ანესთეზიოლოგია |
ბავშვთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
14 |
ანესთეზიოლოგია |
მოზრდილთა სტაციონარული დახმარება |
20 |
15 |
ანესთეზიოლოგია |
ბავშვთა სტაციონარული დახმარება |
20 |
16 |
ანესთეზიოლოგია |
მოზრდილთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
17 |
აუდიოლოგია |
|
20 |
18 |
ახალი დიაგნოსტიკური საშუალებების, სამკურნალო და ბიოლოგიურად აქტიური ნივთიერებებისა და პრეპარატების კლინიკური კვლევა |
|
50 |
19 |
ახალი სამედიცინო ხელსაწყოების, აპარატების, სამკურნალო-დიაგნოსტიკური კომპლექტების აპრობაცია |
|
50 |
20 |
ახალი სამედიცინო ხელსაწყოების, აპარატების, სამკურნალო-დიაგნოსტიკური კომპლექტების დანერგვა |
|
50 |
21 |
ახალი სამედიცინო ხელსაწყოების, აპარატების, სამკურნალო-დიაგნოსტიკური კომპლექსების შ ემუშავება |
|
50 |
22 |
ბავშვების სამედიცინო პატრონაჟი |
|
10 |
23 |
ბაქტერიოლოგიური გამოკვლევები |
|
40 |
24 |
ბიოლოგიური კონტროლი |
|
40 |
25 |
ბიოქიმიური გამოკვლევები |
|
40 |
26 |
ბირთვულ-მაგნიტური რეზონანსი |
|
100 |
27 |
გასტრეონტეროლოგია |
ბავშვთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
28 |
გასტრეონტეროლოგია |
ბავშვთა სტაციონარული დახმარება |
20 |
29 |
გასტრეონტეროლოგია |
მოზრდილთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
30 |
გასტრეონტეროლოგია |
მოზრდილთა სტაციონარული დახმარება |
20 |
31 |
გაჯანსაღების ტრადიციული მეთოდებით პროფილაქტიკა, დიაგნოსტიკა და მკურნალობა |
|
50 |
32 |
გენეტიკური შემოწმება და ექსპერტიზა |
|
100 |
33 |
გერიატრია |
მოზრდილთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
34 |
გერიატრია |
მოზრდილთა სტაციონარული დახმარება |
20 |
35 |
გვამის პათოლოგანატომიური გაკვეთა |
|
50 |
36 |
გვამის შემურვა |
|
50 |
37 |
გინეკოლოგია |
ბავშვთა ამბულატორიულ-პოლიკლინიკური დახმარება |
50 |
38 |
გინეკოლოგია |
მოზრდილთა სტაციონარული დახმარება |
50 |
39 |
გინეკოლოგია |
ბავშვთა სტაციონარული დახმარება |
50 |
40 |
დეკრეტირებულ პირთა პროფვარგისიანობის შემოწმება და ექსპერტიზა - IV დონე |
|
50 |
41 |
დერმატოლოგია და ვენეროლოგია |
მოზრდილთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
42 |
დერმატოლოგია და ვენეროლოგია |
ბავშვთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
43 |
დერმატოლოგია და ვენეროლოგია |
მოზრდილთა სტაციონარული დახმარება |
20 |
44 |
დერმატოლოგია და ვენეროლოგია |
ბავშვთა სტაციონარული დახმარება |
20 |
45 |
დერმატოლოგიურ-ვენეროლოგიური შემოწმება და ექსპერტიზა |
|
100 |
46 |
დონორობის ორგანიზება |
|
20 |
47 |
დროებითი შრომისუუნარობის ექსპერტიზა |
|
50 |
48 |
ენდოკრინოლოგია |
მოზრდილთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
49 |
ენდოკრინოლოგია |
ბავშვთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
50 |
ენდოკრინოლოგია |
მოზრდილთა სტაციონარული დახმარება |
20 |
51 |
ენდოკრინოლოგია |
ბავშვთა სტაციონარული დახმარება |
20 |
52 |
ენდოსკოპია |
მოზრდილთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
53 |
ენდოსკოპია |
ბავშვთა ამბოლატორიულ-პოლიკლინიკური დახმარება |
20 |
54 |
ენდოსკოპია |
მოზრდილთა სტაციონარული დახმარება |
20 |
55 |
ენდოსკოპია |
ბავშვთა სტაციონარული დახმარება |
20 |
56 |
ენერგოინფორმატიკა |
|
50 |
57 |
ეპიდემიოლოგია |
|
20 |
58 |
ესთეტიკური ქირურგია |
მოზრდილთა ამბულატორიულ-პოლიკლინიკური დახმარება |
100 |
59 |
ესთეტიკური ქირურგია |
მოზრდილთა სტაციონალური დახმარება |
100 |
60 |
ექსტრემალურ სიტუაციებში გადაუდებელი სამედიცინო დახმარების ორგანიზაცია |
|
20 |
61 |
ვირუსოლოგიური გამოკვლევები |
|
40 |
62 |
ზოგადი საექიმო პრაქტიკა, ოჯახის ექიმი |
|
40 |
63 |
თერაპია |
მოზრდილთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
64 |
თერაპია |
მოზრდილთა სტაციონალური დახმარება |
20 |
65 |
თერაპია |
მოზრდილთა დღის სტაციონარი |
20 |
66 |
თერაპიული კოსმეტოლოგია |
მოზრდილთა ამბულატორიულ-პოლიკლინიკური დახმარება |
50 |
67 |
თერაპიული კოსმეტოლოგია |
ბავშვთა ამბულატორიულ-პოლიკლინიკური დახმარება |
50 |
68 |
თერაპიული კოსმეტოლოგია |
მოზრდილთა სტაციონალური დახმარება |
50 |
69 |
თერაპიული კოსმეტოლოგია |
ბავშვთა სტაციონალური დახმარება |
50 |
70 |
იმუნოლოგიური გამოკვლევები |
|
20 |
71 |
ინფექციური დაავადებები |
მოზრდილთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
72 |
ინფექციური დაავადებები |
ბავშვთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
73 |
ინფექციური დაავადებები |
მოზრდილთა სტაციონარული დახმარება |
20 |
74 |
ინფექციური დაავადებები |
ბავშვთა სტაციონარული დახმარება |
20 |
75 |
კარდიოლოგია |
მოზრდილთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
76 |
კარდიოლოგია |
მოზრდილთა სტაციონარული დახმარება |
20 |
77 |
კარდიოლოგია/კარდიორევმატოლოგია |
ბავშვთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
78 |
კარდიოლოგია/კარდიორევმატოლოგია |
ბავშვთა სტაციონარული დახმარება |
20 |
79 |
კარდიოქირურგია |
მოზრდილთა სტაციონარული დახმარება |
50 |
80 |
კარდიოქირურგია |
ბავშვთა სტაციონარული დახმარება |
50 |
81 |
კბილის სატექნიკო სამუშაოები (მათ შორის ჩამოსხმა) |
|
100 |
82 |
კლინიკურ-დიაგნოსტიკური გამოკვლევები |
|
40 |
83 |
კლინიკური იმუნოლოგია |
მოზრდილთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
84 |
კლინიკური იმუნოლოგია |
ბავშვთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
85 |
კლინიკური იმუნოლოგია |
მოზრდილთა სტაციონარული დახმარება |
20 |
86 |
კლინიკური იმუნოლოგია |
ბავშვთა სტაციონარული დახმარება |
20 |
87 |
კლინიკური ტოქსიკოლოგია |
მოზრდილთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
88 |
კლინიკური ტოქსიკოლოგია |
ბავშვთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
89 |
კლინიკური ტოქსიკოლოგია |
მოზრდილთა სტაციონარული დახმარება |
20 |
90 |
კლინიკური ტოქსიკოლოგია |
ბავშვთა სტაციონარული დახმარება |
20 |
91 |
კლინიკური ტრანსფუზიოლოგია |
მოზრდილთა სტაციონარული დახმარება |
20 |
92 |
კლინიკური ტრანსფუზიოლოგია |
ბავშვთა სტაციონარული დახმარება |
20 |
93 |
კომბუსტიოლოგია |
მოზრდილთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
94 |
კომბუსტიოლოგია |
ბავშვთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
95 |
კომბუსტიოლოგია |
მოზრდილთა სტაციონარული დახმარება |
20 |
96 |
კომბუსტიოლოგია |
ბავშვთა სტაციონარული დახმარება |
20 |
97 |
კომპიუტერული ტომოგრაფია |
|
100 |
98 |
კრიტიკული მედიცინა |
მოზრდილთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
99 |
კრიტიკული მედიცინა |
ბავშვთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
100 |
კრიტიკული მედიცინა |
მოზრდილთა სტაციონარული დახმარება |
20 |
101 |
კრიტიკული მედიცინა |
ბავშვთა სტაციონარული დახმარება |
20 |
102 |
კურორტოლოგია |
მოზრდილთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
103 |
კურორტოლოგია |
ბავშვთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
104 |
კურორტოლოგია |
მოზრდილთა სტაციონარული დახმარება |
20 |
105 |
კურორტოლოგია |
ბავშვთა სტაციონარული დახმარება |
20 |
106 |
ლაზეროთერაპია |
მოზრდილთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
107 |
ლაზეროთერაპია |
ბავშვთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
108 |
ლაზეროთერაპია |
მოზრდილთა სტაციონარული დახმარება |
20 |
109 |
ლაზეროთერაპია |
ბავშვთა სტაციონარული დახმარება |
20 |
110 |
ლოგოპედია |
მოზრდილთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
111 |
ლოგოპედია |
ბავშვთა ამბულატორიულ-პოლიკლინიკურიდახმარება |
20 |
112 |
ლოგოპედია |
მოზრდილთა სტაციონარული დახმარება |
20 |
113 |
ლოგოპედია |
ბავშვთა სტაციონარული დახმარება |
20 |
114 |
მანუალური თერაპია |
|
50 |
115 |
მასაჟი (სამკურნალო, სპორტული, ჰიგიენური და კოსმეტიკური) |
|
50 |
116 |
მეანობა |
მოზრდილთა სტაციონარული დახმარება |
50 |
117 |
მეანობა და გინეკოლოგია |
მოზრდილთა ამბულატორიულ-პოლიკლინიკური დახმარება |
50 |
118 |
მეტაბოლოგია |
მოზრდილთა სტაციონარული დახმარება |
20 |
119 |
მობილური სამედიცინო დახმარება სპეციალიზ ებულ ტრანსპორტში |
|
100 |
120 |
მოზრდილთა სამედიცინო პატრონაჟი |
|
10 |
121 |
მოსახლეობის მასობრივი იმუნიზაციის ორგანიზება და ჩატარება |
|
20 |
122 |
მძღოლების წინასარეისო სამედიცინო შემოწმება |
|
50 |
123 |
ნარკოლოგია |
მოზრდილთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
124 |
ნარკოლოგია |
ბავშვთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
125 |
ნარკოლოგია |
მოზრდილთა სტაციონარული დახმარება |
20 |
126 |
ნარკოტიკული საშუალებებისა და ფსიქოტროპული ნივთიერებების შემუშავება, შექმნა |
სამეცნიერო კვლევითი საქმიანობა |
100 |
127 |
ნარკოტიკული საშუალებებისა და ფსიქოტროპული ნივთიერებებისა და სპეციალურ კონტროლს დაქვემდებარებული ნივთიერებების შემცველი კომბინირებული პრეპარატების გადამუშავება |
სასწავლო, სამეცნიერო-კვლევითი და საექსპერტო-დიაგნოსტიკური საქმიანობა |
100 |
128 |
ნარკოტიკული საშუალებების შენახვა და მოხმარება |
|
50 |
129 |
ნატუროპათია |
|
50 |
130 |
ნევროლოგია |
მოზრდილთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
131 |
ნევროლოგია |
ბავშვთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
132 |
ნევროლოგია |
მოზრდილთა სტაციონარული დახმარება |
20 |
133 |
ნევროლოგია |
ბავშვთა სტაციონარული დახმარება |
20 |
134 |
ნევროლოგია |
მოზრდილთა დღის სტაციონარი |
20 |
135 |
ნეიროქირურგია |
მოზრდილთა სტაციონარული დახმარება |
20 |
136 |
ნეიროქირურგია |
ბავშვთა სტაციონარული დახმარება |
20 |
137 |
ნეონატოლოგია |
|
20 |
138 |
ნეფროლოგია |
მოზრდილთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
139 |
ნეფროლოგია |
ბავშვთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
140 |
ნეფროლოგია |
მოზრდილთა სტაციონარული დახმარება |
20 |
141 |
ნეფროლოგია |
ბავშვთა სტაციონარული დახმარება |
20 |
142 |
ონკოლოგია |
მოზრდილთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
143 |
ონკოლოგია |
ბავშვთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
144 |
ონკოლოგია |
მოზრდილთა სტაციონარული დახმარება |
20 |
145 |
ონკოლოგია |
ბავშვთა სტაციონარული დახმარება |
20 |
146 |
ორგანოებისა და ქსოვილების აღება |
მოზრდილთა სტაციონარული დახმარება |
20 |
147 |
ორგანოებისა და ქსოვილების აღება |
ბავშვთა სტაციონარული დახმარება |
20 |
148 |
ორგანოებისა და ქსოვილების გადანერგვა |
მოზრდილთა სტაციონარული დახმარება |
50 |
149 |
ორგანოებისა და ქსოვილების გადანერგვა |
ბავშვთა სტაციონარული დახმარება |
50 |
150 |
ორგანოებისა და ქსოვილების შენახვა |
მოზრდილთა სტაციონარული დახმარება |
50 |
151 |
ორგანოებისა და ქსოვილების შენახვა |
ბავშვთა სტაციონარული დახმარება |
50 |
152 |
ორთოდონტია |
ბავშვთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
153 |
ორთოდონტია |
მოზრდილთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
154 |
ოტორინონგოლოგია (მათ შორის სურდოლოგია) |
მოზრდილთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
155 |
ოტორინონგოლოგია (მათ შორის სურდოლოგია) |
ბავშვთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
156 |
ოტორინონგოლოგია (მათ შორის სურდოლოგია) |
მოზრდილთა სტაციონარული დახმარება |
20 |
157 |
ოტორინონგოლოგია (მათ შორის სურდოლოგია) |
ბავშვთა სტაციონარული დახმარება |
20 |
158 |
ოფთალმოლოგია |
მოზრდილთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
159 |
ოფთალმოლოგია |
ბავშვთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
160 |
ოფთალმოლოგია |
მოზრდილთა სტაციონარული დახმარება |
20 |
161 |
ოფთალმოლოგია |
ბავშვთა სტაციონარული დახმარება |
20 |
162 |
ოფთალმოლოგია ოფთომეტრიული |
მოზრდილთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
163 |
ოფთალმოლოგია ოფთომეტრიული |
ბავშვთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
164 |
ოფთალმოლოგია ოფთომეტრიული |
მოზრდილთა სტაციონარული დახმარება |
20 |
165 |
ოფთალმოლოგია ოფთომეტრიული |
ბავშვთა სტაციონარული დახმარება |
20 |
166 |
პათოლოგანატომიური გამოკვლევა და ექსპერტიზა |
|
50 |
167 |
პათომორფოლოგიური დიაგნოსტიკა |
|
40 |
168 |
პედიატრია |
ბავშვთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
169 |
პედიატრია |
ბავშვთა სტაციონარული დახმარება |
20 |
170 |
პედიატრია |
ბავშვთა დღის სტაციონარი |
20 |
171 |
პროთეზირება ორთოპედიული |
მოზრდილთა ამბულატორიულ-პოლიკლინიკური დახმარება |
50 |
172 |
პროთეზირება ორთოპედიული |
ბავშვთა ამბულატორიულ-პოლიკლინიკური დახმარება |
50 |
173 |
პროთეზირება ორთოპედიული |
მოზრდილთა სტაციონარული დახმარება |
50 |
174 |
პროთეზირება ორთოპედიული |
ბავშვთა სტაციონარული დახმარება |
50 |
175 |
პროთეზირება ყურის |
მოზრდილთა ამბულატორიულ-პოლიკლინიკური დახმარება |
50 |
176 |
პროთეზირება ყურის |
ბავშვთა ამბულატორიულ-პოლიკლინიკური დახმარება |
50 |
177 |
პროთეზირება ყურის |
მოზრდილთა სტაციონარული დახმარება |
50 |
178 |
პროთეზირება ყურის |
ბავშვთა სტაციონარული დახმარება |
50 |
179 |
პროფესიულ დაავადებათა გამოკვლევა და ექსპერტიზა |
|
50 |
180 |
პროფპათოლოგია |
მოზრდილთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
181 |
პროფპათოლოგია |
მოზრდილთა სტაციონარული დახმარება |
20 |
182 |
პროქტოლოგია |
მოზრდილთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
183 |
პროქტოლოგია |
ბავშვთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
184 |
პროქტოლოგია |
მოზრდილთა სტაციონარული დახმარება |
20 |
185 |
პროქტოლოგია |
ბავშვთა სტაციონარული დახმარება |
20 |
186 |
პულმონოლოგია |
მოზრდილთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
187 |
პულმონოლოგია |
ბავშვთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
188 |
პულმონოლოგია |
მოზრდილთა სტაციონარული დახმარება |
20 |
189 |
პულმონოლოგია |
ბავშვთა სტაციონარული დახმარება |
20 |
190 |
რადიოლოგია |
მოზრდილთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
191 |
რადიოლოგია |
ბავშვთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
192 |
რადიოლოგია |
მოზრდილთა სტაციონარული დახმარება |
20 |
193 |
რადიოლოგია |
ბავშვთა სტაციონარული დახმარება |
20 |
194 |
რადიოლოგიური დიაგნოსტიკა |
|
50 |
195 |
რეაბილიტაცია |
მოზრდილთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
196 |
რეაბილიტაცია |
ბავშვთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
197 |
რეაბილიტაცია |
მოზრდილთა სტაციონარული დახმარება |
20 |
198 |
რეაბილიტაცია |
ბავშვთა სტაციონარული დახმარება |
20 |
199 |
რეგიონში სამედიცინო დახმარება |
|
100 |
200 |
რევმატოლოგია |
მოზრდილთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
201 |
რევმატოლოგია |
მოზრდილთა სტაციონარული დახმარება |
20 |
202 |
რენტგენოლოგიური დიაგნოსტიკა |
|
40 |
203 |
რეპროდუქტოლოგია |
მოზრდილთა ამბულატორიულ-პოლიკლინიკური დახმარება |
50 |
204 |
რეპროდუქტოლოგია |
მოზრდილთა სტაციონარული დახმარება |
50 |
205 |
რეფლექსოთერაპია (აკუპუნქტურა) |
|
50 |
206 |
სადეზინფექციო საქმიანობა - დეზინსექცია |
|
40 |
207 |
|
სადეზინფექციო საქმიანობა - დეზინფექცია |
40 |
208 |
სადეზინფექციო საქმიანობა - დერატიზაცია |
|
40 |
209 |
საექთნო სამედიცინო დახმარება |
|
10 |
210 |
სამედიცინო გენეტიკა |
მოზრდილთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
211 |
სამედიცინო გენეტიკა |
ბავშვთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
212 |
სამედიცინო გენეტიკა |
ბავშვთა სტაციონარული დახმარება |
20 |
213 |
სამედიცინო პარაზიტოლოგია |
მოზრდილთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
214 |
სამედიცინო პარაზიტოლოგია |
ბავშვთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
215 |
სამედიცინო პარაზიტოლოგია |
მოზრდილთა სტაციონარული დახმარება |
20 |
216 |
სამედიცინო პარაზიტოლოგია |
ბავშვთა სტაციონარული დახმარება |
20 |
217 |
სამედიცინო ხარისხის აუდიტი |
|
200 |
218 |
სამედიცინო-სოციალური ექსპერტიზა |
|
50 |
219 |
სამედიცინო-ტექნიკური ნაკეთობების საბითუმო რეალიზაცია |
|
100 |
220 |
სამედიცინო-ტექნიკური ნაკეთობების საცალო რეალიზაცია |
|
100 |
221 |
სამედიცინო-ტექნიკურ ნაკეთობათა ტექნიკური მომსახურება (ფუნქციური მდგომარეობის დადგენა, მიმდინარე და სხვა მომსახურება_მონტაჟი, შეკეთება დემონტაჟი) სახეობების მიხედვით |
|
100 |
222 |
სამედიცინო-ტექნიკური ნაკეთობების წარმოება |
|
100 |
223 |
სამკურნალო კვება |
მოზრდილთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
224 |
სამკურნალო კვება |
ბავშვთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
225 |
სამკურნალო კვება |
მოზრდილთა სტაციონარული დახმარება |
20 |
226 |
სამკურნალო კვება |
ბავშვთა სტაციონარული დახმარება |
20 |
227 |
სამკურნალო ფიზკულტურა და სპორტული მედიცინა |
მოზრდილთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
228 |
სამკურნალო ფიზკულტურა და სპორტული მედიცინა |
ბავშვთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
229 |
სამკურნალო ფიზკულტურა და სპორტული მედიცინა |
მოზრდილთა სტაციონარული დახმარება |
20 |
230 |
სამკურნალო ფიზკულტურა და სპორტული მედიცინა |
ბავშვთა სტაციონარული დახმარება |
20 |
231 |
სამხედრო-სამედიცინო და წვევამდელთა ჯანმრთელობის მდგომარეობის შემოწმება და ექსპერტიზა |
|
50 |
232 |
სანატორიული მკურნალობა |
|
50 |
233 |
სანიტარული განათლება |
|
20 |
234 |
სასამართლო-სამედიცინო ექსპერტიზა |
|
50 |
235 |
სასამართლო-ფსიქიატრიული ექსპერტიზა |
|
50 |
236 |
სასწრაფო და გადაუდებელი სამედიცინო დახმარება |
|
50 |
237 |
საშუალო სამედიცინო პერსონალის უწყვეტი განათლება |
|
100 |
238 |
საშუალო სამედიცინო საგანმანათლებლო (განათლების სამინისტროს მიერ ლიცენზირებული) დაწესებულების საბაზო კლინიკური საქმიანობა |
|
100 |
239 |
საწარმოო ტრანსფუზიოლოგია |
|
100 |
240 |
სეროლოგიური გამოკვლევები |
|
40 |
241 |
სექსოლოგია |
მოზრდილთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
242 |
სექსოლოგია |
მოზრდილთა სტაციონარული დახმარება |
20 |
243
|
სპორტსმენების საექიმო კონტროლი
|
მოზრდილთა ამბულატორიულ-პოლიკლინიკური დახმარება ბავშვთა ამბულატორიულ- პოლიკლინიკური დახმარება მოზრდილთა ამბულატორიულ-პოლიკლინიკური დახმარება ბავშვთა ამბულატორიულ-პოლიკლინიკური დახმარება მოზრდილთა ამბულატორიულ-პოლიკლინიკური დახმარება ბავშვთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20
|
250 |
სტომატოლოგია ქირურგიული |
მოზრდილთა სტაციონარული დახმარება |
50 |
251 |
სტომატოლოგია ქირურგიული |
ბავშვთა სტაციონარული დახმარება |
50 |
252 |
ტრავმატოლოგია და ორთოპედია |
მოზრდილთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
253 |
ტრავმატოლოგია და ორთოპედია |
ბავშვთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
254 |
ტრავმატოლოგია და ორთოპედია |
მოზრდილთა სტაციონარული დახმარება |
20 |
255 |
ტრავმატოლოგია და ორთოპედია |
ბავშვთა სტაციონარული დახმარება |
20 |
256 |
ტრანსპორტირებისას სამედიცინო თანხლება |
|
50 |
257 |
ულტრაბგერითი დიაგნოსტიკა |
|
100 |
258 |
უმაღლესი სამედიცინო საგანმანათლებლო დაწესებულების (განათლების სამინისტროს მიერ ლიცენზირებული) საბაზო კლინიკური საქმიანობა |
|
100 |
259 |
უმაღლესის შემდგომი პროფესიული მზადება (რეზიდენტურა) |
|
100 |
260 |
უროლოგია |
მოზრდილთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
261 |
უროლოგია |
ბავშვთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
262 |
უროლოგია |
მოზრდილთა სტაციონარული დახმარება |
20 |
263 |
უროლოგია |
ბავშვთა სტაციონარული დახმარება |
20 |
264 |
უწყვეტი სამედიცინო განათლება |
|
100 |
265 |
ფთიზიატრია |
მოზრდილთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
266 |
ფთიზიატრია |
ბავშვთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
267 |
ფთიზიატრია |
მოზრდილთა სტაციონარული დახმარება |
20 |
268 |
ფთიზიატრია |
ბავშვთა სტაციონარული დახმარება |
20 |
269 |
ფიზიოთერაპია |
მოზრდილთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
270 |
ფიზიოთერაპია |
ბავშვთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
271 |
ფიზიოთერაპია |
მოზრდილთა სტაციონარული დახმარება |
20 |
272 |
ფიზიოთერაპია |
ბავშვთა სტაციონარული დახმარება |
20 |
273 |
ფიტოთერაპია |
|
50 |
274 |
ფსიქიატრია |
მოზრდილთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
275 |
ფსიქიატრია |
მოზრდილთა სტაციონარული დახმარება |
20 |
276 |
ფსიქიატრია |
ბავშვთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
277 |
ფსიქიატრია |
ბავშვთა სტაციონარული დახმარება |
20 |
278 |
ფსიქიატრიული შემოწმება |
|
50 |
279 |
ფსიქოაქტიური ნივთიერებებით გამოწვეული თრობის შემოწმება და ექსპერტიზა |
|
100 |
280 |
ფსიქოთერაპია |
მოზრდილთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
281 |
ფსიქოთერაპია |
ბავშვთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
282 |
ფსიქოთერაპია |
მოზრდილთა სტაციონარული დახმარება |
20 |
283 |
ფსიქოთერაპია |
ბავშვთა სტაციონარული დახმარება |
20 |
284 |
ფუნქციური დიაგნოსტიკა |
|
50 |
285 |
ქიმიურ-ტოქსიკოლოგიური დიაგნოსტიკა |
|
40 |
286 |
ქირურგია |
ბავშვთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
287 |
ქირურგია |
მოზრდილთა დღის სტაციონარი |
20 |
288 |
ქირურგია |
ბავშვთა დღის სტაციონარი |
20 |
289 |
ქირურგია |
გულმკერდის მოზრდილთა სტაციონარული დახმარება |
20 |
290 |
ქირურგია |
გულმკერდის ბავშვთა სტაციონარული დახმარება |
20 |
291 |
ქირურგია ზოგადი |
მოზრდილთა სტაციონარული დახმარება |
20 |
292 |
ქირურგია ზოგადი |
ბავშვთა სტაციონარული დახმარება |
20 |
293 |
ქირურგია ზოგადი |
მოზრდილთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
294 |
ქირურგია პლასტიკური და რეკონსტრუქციული |
მოზრდილთა ამბულატორიულ-პოლიკლინიკური დახმარება |
100 |
295 |
ქირურგია პლასტიკური და რეკონსტრუქციული |
მოზრდილთა სტაციონარული დახმარება |
100 |
296 |
ქირურგია პლასტიკური და რეკონსტრუქციული |
ბავშვთა სტაციონარული დახმარება |
100 |
297 |
ქირურგია სისხლძარღვთა |
მოზრდილთა სტაციონარული დახმარება |
50 |
298 |
ქირურგია სისხლძარღვთა |
ბავშვთა სტაციონარული დახმარება |
50 |
299 |
ქირურგია ჩირქოვანი |
მოზრდილთა სტაციონარული დახმარება |
20 |
300 |
ქირურგია ჩირქოვანი |
ბავშვთა სტაციონარული დახმარება |
20 |
301 |
შრომათერაპია |
მოზრდილთა ამბულატორიულ-პოლიკლინიკური დახმარება
|
20 |
302 |
შრომათერაპია |
მოზრდილთა სტაციონარული დახმარება |
20 |
303 |
ცალკეულ პროფესიათა საქმიანობის უფლების, ან ნებართვის მისაღებად მოქალაქეთა ჯანმრთელობის მდგომარეობის შემოწმება და ექსპერტიზა - I დონე |
|
50 |
304 |
ცალკეულ პროფესიათა საქმიანობის უფლების, ან ნებართვის მისაღებად მოქალაქეთა ჯანმრთელობის მდგომარეობის შემოწმება და ექსპერტიზა - II დონე |
|
50 |
305 |
ცალკეულ პროფესიათა საქმია ნობის უფლების, ან ნებართვის მისაღებად მოქალაქეთა ჯანმრთელობის მდგომარეობის შემოწმება და ექსპერტიზა - III დონე |
|
50 |
306 |
ციტოგენეტიკური გამოკვლევები |
|
40 |
307 |
ციტოლოგიური დიაგნოსტიკა |
|
40 |
308 |
ჰემატოლოგია |
მოზრდილთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
309 |
ჰემატოლოგია |
ბავშვთა ამბულატორიულ-პოლიკლინიკური დახმარება |
20 |
310 |
ჰემატოლოგია |
მოზრდილთა სტაციონარული დახმარება |
20 |
311 |
ჰემატოლოგია |
ბავშვთა სტაციონარული დახმარება |
20 |
312 |
ჰომეოპათია |
|
20 |
ლიცენზირებადი ფარმაცევტული საქმიანობა
№ |
სალიცენზიო საქმიანობა |
მოსაკრებელი |
1. |
სამკურნალო საშუალებების (მათ შორის სპეციალურ კონტროლს დაქვებდებარებული საშუალებების) მომზადება, რეალიზაცია (I ჯგუფის აფთიაქი ); |
300 |
2. |
სამკურნალო საშუალებების რეალიზაცია (II ჯგუფის აფთიაქი); |
300 |
3. |
სამკურნალო საშუალებების (გარდა ნარკოტიკული საშუალებებისა ) რეალიზაცია (II ჯგუფის აფთიაქი); |
300 |
4. |
სამკურნალო საშუალებების (გარდა სპეციალურ კონტროლს დაქვემდებარებული საშუალებებისა ) რეალიზაცია (III ჯგუფის აფთიაქი); |
300 |
5. |
ურეცეპტოდ გასაცემი სამკურნალო საშუალებების საცალო რეალიზაცია (აფთიაქის ფილიალი); |
50 |
6. |
სამკურნალო საშუალებების მომზადება და სამკურნალო-პროფილაქტიკური დაწესებულებების განყოფილებებზე გაცემა, საცალო რეალიზაციის გარეშე (სამკურნალო-პროფილაქტიკური დაწესებულებების აფთიაქი); |
50 |
7. |
სამკურნალო საშუალებების სამკურნალო-პროფილაქტიკური დაწესებულებების განყოფილებებზე გაცემა, საცალო რეალიზაციის გარეშე (სამკურნალო-პროფილაქტიკური დაწესებულებების აფთიაქი); |
50 |
8. |
სამკურნალო საშუალებების (გარდა სპეციალურ კონტროლს დაქვემდებარებული საშუალებებისა) იმპორტი, ექსპორტი, რეექსპორტი და საბითუმო რეალიზაცია (ფარმაცევტული ბაზა); |
400 |
9. |
ნარკოტიკული საშუალებების იმპორტი, ექსპორტი, რეექსპორტი და საბითუმო რეალიზაცია (ფარმაცევტული ბაზა); |
100 |
10. |
სპეციალურ კონტროლს დაქვემდებარებული ნივთიერებების (გარდა ნარკოტიკული საშუალებებისა) იმპორტი, ექსპორტი, რეექსპორტი და საბითუმო რეალიზაცია (ფარმაცევტული ბაზა); |
100 |
11. |
სამკურნალო საშუალებების (გარდა ნარკოტიკული საშუალებებისა) წარმოება; წარმოებული სამკურნალო საშუალებების (გარდა ნარკოტიკული საშუალებებისა) ექსპორტი და რეალიზაცია; სამკურნალო საშუალებების (გარდა ნარკოტიკული საშუალებებისა) იმპორტი საკუთარი წარმოებისათვის (ფარმაცევტული წარმოება); |
400 |
12. |
სპეციალურ კონტროლს დაქვემდებარებული ნივთიერებების შემცველი იმ კომბინირებული პრეპარატების წარმოება, რომლებიც არ მიეკუთვნება ნარკოტიკული საშუალებების ჩამონათვალს; წარმოებული პრეპარატების ექსპორტი და რეალიზაცია; პრეპარატების იმპორტი საკუთარი წარმოებისათვის (ფარმაცევტული წარმოება); |
100 |
13. |
სამკურნალო საშუალებების ხარისხის კონტროლი (ლაბორატორია) |
300 |
განცხადება ლიცენზიის მისაღებად. სალიცენზიო პირობები
მაძიებელი ლიცენზიის მისაღებად მიმართავს ლიცენზიის გამცემს წერილობითი განცხადებით. განცხადებაში აღინიშნება:
ლიცენზიის გამცემი ორგანოს დასახელება, რომელსაც მიმართავს განმცხადებელი;
განმცხადებლის ვინაობა, მისამართი, სამეწარმეო რეესტრის მონაცემები (სახელწოდება, ორგანიზაციულ-სამართლებრივი ფორმა, ადგილსამყოფელი, ხელმძღვანელი პირი, რეგისტრაციის ნომერი და თარიღი);
რომელი ლიცენზიის მიღებას მოითხოვს ლიცენზიის მაძიებელი;
განცხადების წარდგენის თარიღი და განმცხადებლის ხელმოწერა;
განცხადებაზე თანდართული საბუთების ნუსხა:
- სალიცენზიო მოსაკრებლის გადახდის დამადასტურებელი საბუთი;
- წარმომადგენლის მიერ განცხადების შეტანის შემთხვევაში სათანადო რწმუნებულება;
ა) სამედიცინო საქმიანობაზე ლიცენზიის მიღებისათვის საჭიროა:
ა.ა) ინფორმაცია ლიცენზირებადი სამედიცინო საქმიანობის განმახორციელებელი სპეციალისტების პროფესიული მომზადების შესახებ (სახელმწიფო სერტიფიკატის ასლის წარმოდგენით);
ა.ბ) სამედიცინო დაწესებულების პასპორტი;
ა.გ) ჰიგიენური სერტიფიკატი;
ა.დ) განაცხადი ხარისხის გარე კონტროლის სისტემაში მონაწილეობაზე.
ბ) ფარმაცევტულ საქმიანობაზე ლიცენზიის მიღებისათვის საჭიროა:
ბ.ა) ინფორმაცია ლიც ენზირებადი ფარმაცევტული საქმიანობის განმახორციელებელი სპეციალისტების პროფესიული მომზადების შესახებ (სახელმწიფო სერტიფიკატის ასლის წარმოდგენით);
ბ.ბ) ფარმაცევტული დაწესებულების პასპორტი1;
ბ.გ) ჰიგიენური სერტიფიკატი;
ბ.დ) სპეციალურ კონტროლს დაქვემდებარებული საშუალებების ბრუნვის შემთხვევაში პასუხისმგებელი ფარმაცევტის დანიშვნის ბრძანება, ცნობები მისი ნასამართლობისა და ნარკოლოგიურ დაწესებულებაში აღრიცხვაზე არყოფნის შესახებ.
ბ.ე) განაცხადი ხარისხის გარე კონტროლის სისტემაში მონაწილეობაზე .
პასპორტი არის საჯარო ინფორმაცია, იგი (ასლი ან ელექტრო-ვერსია) უნდა გაიცეს მოთხოვნისთანავე.
სამკურნალო საშუალებების წარმოებისა და მათი რეალიზაციის ლიცენზიის მისაღებად დამატებით წარმოდგენილ უნდა იქნეს იმ პრეპარატების ჩამონათვალი, რომელთა წარმოების/რეალიზაციის უფლებასაც ითხოვს ლიცენზიის მაძიებელი.
ლიცენზიის მფლობელი ვალდებულია დაიცვას კანონმდებლობით განსაზღვრული სამედიცინო სტანდარტები, ნორმები და დადგენილი წესით წარუდგინოს სამედიცინო სტატისტიკური მონაცემები ლიცენზიის გამცემს.
ლიცენზიის მიღების პროცესში ანდა ლიცენზიის მიღების შემდეგ განცხადებაში მითითებული სამეწარმეო რეესტრის მონაცემების ცვლილების შემთხვევაში განმცხადებელი (ლიცენზიის მფლობელი) ვალდებულია ამის თაობაზე წერილობით აცნობოს ლიცენზიის გამცემს და წარუდგინოს მას სათანადო დოკუმენტები შესაბამისი ცვლილების განხორციელებიდან 7 სამუშაო დღის განმავლობაში. რეესტრული მონაცემების ცვლილების შემთხვევაში იმართება მარტივი ადმინისტრაციული წარმოება ზოგადი ადმინისტრაციული კოდექსის შესაბამისად.
ლიცენზიის გაცემის წესი
ლიცენზია გაიცემა საჯარო ადმინისტრაციული წარმოების წესით, რომლის დაწყების საფუძველია ლიცენზიის მაძიებლის მიერ შრომის, ჯანმრთელობისა და სოციალური დაცვის სამინისტროში განცხადებისა და მასზე თანდართული საბუთების შეტანა, რომელიც უფლებამოსილია გასცეს მოთხოვნილი სახის ლიცენზია. ლიცენზიის მაძიებელი შეიძლება იყოს ნებისმიერი ფიზიკური ან იურიდიული პირი, ასევე სხვა ორგანიზაციული წარმონაქმნები რომლებიც არ წარმოადგენენ იურიდიულ პირებს (მაგ., ამხანაგობა).
ლიცენზიის გამცემი ორგანო ვალდებულია განცხადება რეგისტრაციაში გაატაროს მიღების დღესვე და დაუსვას მას რეგისტრაციის თარიღი და ნომერი; განმცხადებლის მოთხოვნისას კი, ვალდებულია დაუყოვნებლივ გასცეს ცნობა განცხადების რეგისტრაციაში გატარების შესახებ. ლიცენზიის მაძიებლის მიერწარდგენილი განცხადებისა და მასზე თანდართული მასალების მიღებასა და რეგისტრაციაში გატარებას ახდენს, როგორც წესი, ლიცენზიის გამცემი ორგანოს კანცელარია.
თავდაპირველად, ლიცენზიის გამცემი ორგანო განცხადების რეგისტრაციიდან 3 დღის ვადაში ამოწმებს აკმაყოფილებს თუ არა წარმოდგენილი განცხადება და მასზე თანდართული მასალა დადგენილ მოთხოვნებს. მოთხოვნები ლიცენზირების სფეროში დადგენილია მხოლოდ კანონით. ადმინისტრაციული წარმოების ეს საფეხური გულისხმობს იმის შემოწმებას, რომ განცხადება შეესაბამება თუ არა ზოგადი ადმინისტრაციული კოდექსის 78-ე, „სამეწარმეო საქმიანობის ლიცენზიისა და ნებართვის გაცემის საფუძვლების შესახებ“ კანონის მე-9 მუხლისა და „სამედიცინო და ფარმაცევტული საქმიანობის ლიცენზირების შესახებ“ კანონის მე-6 მუხლის მოთხოვნებს; ასევე, უნდა შემოწმდეს განცხადებას ერთვის თუ არა სალიცენზიო მოსაკრებლის გადახდის დამადასტურებელი ქვითარი. უნდა აღინიშნოს, რომ შესაბამისობის შემოწმებისას არ ხდება წარმოდგენილი დოკუმენტების განხილვა და იგი მოიცავს ძირითადად განცხადების შინაარსის გაცნობასა და თანდართული დოკუმენტების ჩამონათვალის შემოწმებას. შესაბამისობის შემოწმებისას გამოვლინდება შემდეგი გარემოებები:
1. განცხადება ან მასზე დართული მასალები ხომ არ არის წარმოდგენილი უცხო ენაზე. საქმისწარმოება ლიცენზიის გამცემ ორგანოში მიმდინარეობს სახელმწიფო (ქართულ) ენაზე და ლიცენზიის მაძიებელი ვალდებულია ყველა დოკუმენტი წარადგინოს ქართულ ენაზე. თუ რომელიმე დოკუმენტი ან შემდგომ მოთხოვნილი დოკუმენტი ქართულ ენაზე არ არის წარმოდგენილი, ვადა მაძიებლის მიერ დაცულად ითვლება და ლიცენზიის გამცემმა ორგანომ მაძიებელს უნდა განუსაზღვროს ვადა დოკუმენტის თარგმნისა და მისი სანოტარო წესით დადასტურებისათვის, რომელიც არ შეიძლება იყოს 3 დღეზე ნაკლები. სანოტარო წესით დადასტურებული დოკუმენტის წარმოდგენამდე საქმისწარმოების ვადა შეჩერებულად ითვლება;
2. თუ განმცხადებლის მიერ მოთხოვნილი ლიცენზიის გაცემა მიეკუთვნება სხვა ორგანოს უფლებამოსილებას, ადმინისტრაციული ორგანო ვალდებულია არა უგვიანეს 5 დღისა გადაუგზავნოს განცხადება და მასზე თანდართული საბუთები უფლებამოსილ ადმინისტრაციულ ორგანოს, რომლის შესახებაც 2 დღის ვადაში შესაბამისი დასაბუთებით ადმინისტრაციული ორგანო აცნობებს განმცხადებელს;
3. წარმოდგენილი დოკუმენტაციის დადგენილ მოთხოვნებთან შესაბამისობის შემოწმებისას გამოვლინდება საქმის სირთულე ანუ შესაძლებელი იქნება თუ არა ერთთვიან ვადაში გადაწყვეტილების მიღება და საჭირო ხომ არ არის ვადის გაგრძელება 3 თვემდე. უნდა აღინიშნოს, რომ 3 თვემდე გაგრძელება არის მაქსიმუმი (რომელშიც მიეთვლება ერთთვიანი ვადაც) და ვადის გაგრძელებისას ლიცენზიის გამცემმა უნდა იხელმძღვანელოს საქმის სირთულით, სავარაუდოდ რა ვადაში შეძლებს გადაწყვეტილების მიღებას და იგი შეიძლება იყოს თვენახევარი, ორი თვე ან 10 დღით გაგრძელება და ა.შ. ვადის გაგრძელების შესახებ გადაწყვეტილება უნდა იქნეს მიღებული ადმინისტრაციული აქტის (მაგ., ბრძანების) ფორმით, რომლის გამოცემისათვის ცალკე ადმინისტრაციული წარმოება არ იმართება. ადმინისტრაციული აქტი უნდა შეიცავდეს დასაბუთებას, თუ რატომ გახდა აუცილებელი ვადის გაგრძელება და იგი მიიღება არაუგვიანეს 7 დღისა განცხადების რეგისტრაციიდან. ვადის გაგრძელების შესახებ ადმინისტრაციული აქტის მიღებიდან არაუგვიანეს მომდევნო დღეს უნდა ეცნობოს მაძიებელს, რომ ვადა გაგრძელებულია და გადაეცეს მას ვადის გაგრძელების შესახებ ადმინისტრაციული აქტის ასლი;
4. თუ დადგენილი დოკუმენტები არ იქნა სრულად წარდგენილი, მაშინ ლიცენზიის გამცემმა ორგანომ უნდა მოსთხოვოს განმცხადებელს წარადგინოს აუცილებელი დოკუმენტები და განუსაზღვროს მათი წარდგენის ვადა, რომელიც არ უნდა იყოს 5 დღეზე ნაკლები. დოკუმენტების წარმოსადგენად განსაზღვრული ვადა უნდა იყოს გონივრული, ე.ი. ლიცენზიის გამცემმა ორგანომ მიახლოებით უნდა გათვალოს, თუ რა ვადაში შეძლებს მაძიებელი დოკუმენტების წარმოდგენას, გათვალისწინებულ უნდა იქნეს რეალური ვითარება და თუ შესაძლებელია, მოსმენილ იქნეს მაძიებლის პოზიციაც იმის შესახებ, თუ რა ვადაში შეუძლია მას აღნიშნული დოკუმენტის წარმოდგენა. მოთხოვნაში კონკრეტულად უნდა მიეთითოს თუ რა დოკუმენტი ან ინფორმაცია უნდა წარმოადგინოს მაძიებელმა, წინააღმდეგ შემთხვევაში მისთვის განსაზღვრული ვადა გასულად არ ითვლება და მისი ათვლა დაიწყება მოთხოვნის დაკონკრეტებისას. თუ ამ ვადაში არ იქნა წარდგენილი დოკუმენტები, ლიცენზიის გამცემ ორგანოს უფლება აქვს (მაგრამ არ არის ვალდებული) განმცხადებლის მოთხოვნით მხოლოდ ერთხელ, არა უმეტეს 15 დღით დამატებით გააგრძელოს დოკუმენტების წარმოდგენის ვადა. დამატებით მოთხოვნილი დოკუმენტების წარუდგენლობა იწვევს ლიცენზიის მოთხოვნის შესახებ განცხადების განუხილველად დატოვებას. დოკუმენტების წარსადგენად განმცხადებლისათვის მიცემული დამატებითი ვადა არ მიეთვლება საქმის წარმოების საერთო ვადაში, ე.ი. მოცემულ შემთხვევაში საქმისწარმოება შეჩერებულია. ვადის დინება განახლდება შესაბამისი დოკუმენტების წარდგენიდან. განცხადების განუხილველად დატ ოვებისას განმცხადებელს უფლება აქვს კვლავ მიმართოს ადმინისტრაციულ ორგანოს ლიცენზიის მისაღებად; ასეთ შემთხვევაში საქმისწარმოება და შესაბამისად ვადების ათვლა იწყება თავიდან. ადმინისტრაციულ წარმოებაში ვადის ათვლა იწყება განცხადების წარდგენიდან;
5. ექსპერტიზის დანიშვნის აუცილებლობა. ცალკეულ შემთხვევებში, როდესაც წამოიჭრება ისეთი საკითხები, რომლებიც სპეციალურ ცოდნას მოითხოვს და გადაწყვეტილების მიღება შეუძლებელი ხდება ამ საკითხების გარკვევის გარეშე, ლიცენზიის გამცემი ნიშნავს ექსპერტიზას. ექსპერტიზის დანიშვნის აქტში კონკრეტულად უნდა ჩამოყალიბდეს ის კითხვები, რაზედაც სურს პასუხის მიღება ლიცენზიის გამცემ უწყებას. ექსპერტიზა ძირითადად ინიშნება მეცნიერების, ტექნიკის ანდა მედიცინის სფეროში ამა თუ იმ საკითხის გასარკვევად. დაუშვებელია ექსპერტიზა დაინიშნოს სამართლებრივ საკითხებზე.
განცხადებისა და მასზე თანდართული მასალების შესაბამისობის დადგენიდან მომდევნო 3 დღის განმავლობაში უნდა განხორციელდეს შემდეგი ღონისძიებები:
1. ექსპერტიზის დანიშვნის აქტი, განცხადება და თანდართული მასალის ასლები უნდა გადაეგზავნოს ექპერტს დასკვნის წარმოსადგენად. ექსპერტი დასკვნას წარმოადგენს მასალების მიღებიდან ორი კვირის ვადაში. ექსპერტიზის მიმდინარეობისას ვადის დინება შეჩერებულია;
2. უნდა გამოქვეყნდეს ცნობა საჯარო გაცნობისათვის დოკუმენტების წარდგენის შესახებ. ცნობაში უნდა მიეთითოს:
ლიცენზიის გამცემი ორგანო, რომელშიც მიმდინარეობს ადმინისტრაციული წარმოება და მისი მისამართი;
ლიცენზიის მოთხოვნით წარდგენილი განცხადების მოკლე შინაარსი;
ლიცენზიის გაცემის ან გაცემაზე უარის თქმის შესახებ ადმინისტრაციული აქტის გამოცემის ვადა;
ნებისმიერი პირის მიერ საკუთარი მოსაზრების წარდგების ვადა;
ნებისმიერი პირის უფლება, რომ მას მოსაზრების წარდგენისას შეუძლია არ დაასახელოს თავისი ვინაობა;
ცნობის გამოქვეყნების თარიღი.
საჯარო გაცნობისათვის დოკუმენტების წარდგენის შესახებ ცნობა უნდა გამოქვეყნდეს ლიცენზიის გამცემი ორგანოს ოფიციალურ ბეჭდვით ორგანოში. თუ ლიცენზიის გამცემ ორგანოს არა აქვს ოფიციალური ბეჭდვითი ორგანო, მაშინ ცნობა ქვეყნდება იმ ბეჭდვით ორგანოში, რომელიც ვრცელდება ლიცენზიის გამცემი ორგანოს სამოქმედო ტერიტორიაზე და გამოიცემა კვირაში ერთხელ მაინც. უსახსრობის ან სხვა მოტივით ცნობის ბეჭდვით ორგანოში გამოქვეყნების შეუძლებლობისას, ლიცენზიის ორგანო ვალდებულია სულ მცირე ცნობა განათავსოს სამსახურის ოფიციალურ დაფაზე (ე.წ. სტენდზე), სადაც ნებისმიერ პირს ექნება შესაძლებლობა დაუბრკოლებლად გაეცნოს მას ანუ ცნობა ისეთ ადგილას უნდა განთავსდეს, რომ მისი გაცნობა ყველასათვის ხელმისაწვდომი უნდა იყოს და მის გასაცნობად დაინტერესებულ პირს შენობაში შესასვლელად საშვის მიღება არ უნდა დასჭირდეს.
საჯარო გაცნობისათვის დოკუმენტების წარდგენის შესახებ ცნობის გამოქვეყნებიდან 20 დღის ვადაში ნებისმიერ პირს უფლება აქვს ლიცენზიის გამცემ ორგანოში გაეცნოს ლიცენზიის მაძიებლის მიერ წარმოდგენილ დოკუმენტებსა და სხვა დაინტერესებული პირების მოსაზრებებს, ასევე საქმეში არსებულ სხვა მასალას, გააკეთოს ამონაწერები, საკუთარი ხარჯით გადაიღოს ასლები, წარადგინოს საკუთარი მოსაზრება წერილობით, დაესწროს საქმის ზეპირ მოსმენას. მოსაზრების წარდგენა შეუძლია არა მხოლოდ განმცხადებელს, არამედ სხვა ნებისმიერ პირსაც, რომელიც უფლებამოსილია არ დაასახელოს თავისი ვინაობა, ე.ი. დარჩეს ანონიმურად. აქვე ერთმანეთისაგან უნდა გავმიჯნოთ ნებისმიერი პირისა და ნებისმიერი დაინტერესებული პირის ცნებები. ნებისმიერი დაინტერესებული პირი არის ისეთი პირი, რომლის უფლებებზე ან კანონიერ ინტერესებზე ლიცენზიის გაცემა პირდაპირ და უშუალო გავლენას ახდენს; დაინტერესებულ პირად ითვლება ასევე ლიცენზიის მაძიებელი. ნებისმიერი პირი კი არის ისეთი პირი, რომლის უფლებებზე და ინტერესებზე ლიცენზიის გაცემა უშუალო გავლენას არ ახდენს, მაგრამ სურს გამოხატოს თავისი პოზიცია ლიცენზიის კონკრეტულ სუბიექტზე გაცემასთან დაკავშირებით. მათ შორის მნიშვნელოვანი განსხვავებაა ადმინისტრაციულ წარმოებაში მონაწილეობის თვალსაზრისითაც: ნებისმიერი პირი მოსაზრებას წარმოადგენს საჯარო გაცნობისათვის დოკუმენტების წარდგენის შესახებ ცნობის გამოქვეყნებიდან 20 დღის ვადაში და უფლება აქვს მხოლოდ დაესწროს ზეპირი მოსმენის სხდომას, ხოლო ნებისმიერ დაინტერესებულ პირს ენიჭება უფლება ახსნა-განმარტებით გამოვიდეს ზეპირი მოსმენის სხდომაზე.
განმცხადებელს უფლება აქვს ადმინისტრაციულ წარმოებას დაესწროს პირადად ან იყოს წარმოდგენილი წარმომადგენლით. წარმომადგენელი შეიძლება იყოს ნებისმიერი ქმედუნარიანი ფიზიკური პირი. წარმომადგენლობის დროს სავალდებულოა ლიცენზიის გამცემი ორგანოსათვის წარდგენილი იყოს კანონის შესაბამისად გაცემული და გაფორმებული რწმუნებულება (მინდობილობა). ფიზიკური პირის - საქართველოს მოქალაქის, უცხო ქვეყნის მოქალაქის ან მოქალაქეობის არმქონე პირის - მიერ გაცემული რწმუნებულება უნდა დამოწმდეს სანოტარო წესით. რწმუნებულებას იურიდიული პირის ან სხვა ორგანიზაციის სახელით გასცემს დირექტორი ან ის პირი, რომელსაც წესდებით ენიჭება ასეთი უფლებამოსილება. იურიდიული პირის მიერ გაცემული რწმუნებულებას სანოტარო დამოწმება არ ესაჭიროება და საკმარისია მისი მოთავსება იურიდიული პირის სატიტულო ფურცელზე. რწმუნებულების გარდა, წარმომადგენელმა შეიძლება მონაწილეობა მიიღოს დავალების ხელშეკრულებითაც. დავალების ხელშეკრულებას სანოტარო წესით დამოწმება არ ესაჭიროება, მაშინაც კი, როცა მისი ერთ-ერთი მხარე ფიზიკური პირია.
განმცხადებელს ლიცენზიის გაცემის ან გაცემაზე უარის თქმის შესახებ გადაწყვეტილების გამოცემამდე წერილობითი სახით შეუძლია აცილება განუცხადოს ლიცენზიის გამცემი ორგანოს თანამდებობის პირს, რომელსაც კანონის შესაბამისად არა აქვს უფლება მონაწილეობას იღებდეს ადმინისტრაციულ წარმოებაში. საქმის ზეპირი მოსმენის სხდომაზე აცილების თაობაზე შუამდგომლობა შეიძლება დაყენებულ იქნას ზეპირადაც. აცილების საფუძველია, თუ ადმინისტრაციულ წარმოებაში მონაწილეობას იღებს ის თანამდებობის პირი, რომელიც:
ა) თვითონ არის დაინტერესებული მხარე საქმეში;
ბ) საქმეში მონაწილე დაინტერესებული მხარის ან მისი წარმომადგენლის ნათესავია (მოცემულ შემთხვევაში ნათესავებად ითვლება: პირდაპირი ხაზის ნათესავი; მეუღლე, მეუღლის და-ძმა და პირდაპირი ხაზის ნათესავი; აღმავალი ხაზის პირდაპირი ნათესავის და-ძმა; და-ძმა, მათი მეუღლეები და შვილები);
გ) საქმეში მონაწილე დაინტერესებული მხარის წარმომადგენელია;
დ) იყო ექსპერტი მოცემულ საქმესთან დაკავშირებით;
ე) შრომით ურთიერთობაშია საქმეში მონაწილე დაინტერესებულ მხარესთან;
ვ) თვითონ ან მისი ოჯახის წევრი ფლობს აქციებს ან საწესდებო კაპიტალის წილს იმ საწარმოში, რომელიც წარმოადგენს დაინტერესებულ მხარეს;
ზ) საქმეში მონაწილე დაინტერესებული მხარის ან მისი წარმომადგენლის ოჯახის წევრია.
განცხადებისა და მასთან ერთად წარდგენილი სხვა მასალების დადგენილ მოთხოვნებთან შესაბამისობის დადგენიდან ლიცენზიის გაცემის ან გაცემაზე უარის თქმის შესახებ გადაწყვეტილების მიღებამდე, ლიცენზიის გამცემი ორგანო ადგილზე ამოწმებს ლიცენზიის მაძიებლის მიერ წარდგენილ დოკუმნეტებში მითითებულ მონაცემთა სისწორეს. ადგილზე შემოწმებისას ლიცენზიის გამცემი ორგანოს უფლებამოსილი პირი ადგენს ოქმს, რომელსაც ხელს აწერს ლიცენზიის გამცემი ორგანოს წარმომადგენელი და ლიცენზიის მაძიებელი.
სალიცენზიო პირობების ადგილზე შემოწმებისას ლიცენზიის მაძიებელს უფლება აქვს ოქმს დაურთოს ახსნა-განმარტება, გაეცნოს ოქმის შინაარსს, თუ ეთანხმება ხელი მოაწეროს ოქმზე, გამოთქვას შენიშვნები ოქმის შინაარსთან დაკავშირებით. თუ ლიცენზიის მაძიებელი ხელს არ აწერს ოქმს, მაშინ ოქმში უნდა გაკეთდეს სათანადო ჩანაწერი, თუ რატომ არ აწერს იგი ხელს.
ნებისმიერი პირის მიერ მოსაზრების წარმოდგენის ვადის გასვლიდან (ანუ საჯარო გაცნობისათვის დოკუმენტების წარდგენის შესახებ ცნობის გამოქვეყნებიდან 20 დღის შემდეგ) 5 დღის ვადაში იმართება საქმის ზეპირი მოსმენა. ზეპირი მოსმენის გამართვის შესახებ მაძიებელს უნდა ეცნობოს ზეპირი მოსმენის სხდომის გამართვამდე 7 დღით ადრე მაინც და მოწვეულ იქნეს ზეპირ მოსმენაში მონაწილეობის მისაღებად. მოსაწვევ უწყებაში უნდა მიეთითოს ადმინისტრაციული ორგანოს უფლებამოსილება - საქმე განიხილოს და გადაწყვიტოს დაინტერესებული მხარის მონაწილეობის გარეშეც.
ლიცენზიის გამცემი ორგანო ვალდებულია განუმარტოს განმცხადებელს მისი უფლებები და მოვალეობები, გააცნოს განცხადების განხილვის წესი და ვადა, მიუთითოს განცხადებაში დაშვებული შეცდომის შესახებ.
ლიცენზიის გამცემი ორგანო ლიცენზიის თაობაზე გადაწყვეტილებას იღებს მხოლოდ ზეპირი მოსმენის გამართვის საფუძველზე, რომლის ხანგრძლივობა, როგორც წესი, არ უნდა აღემატებოდეს ერთ სამუშაო დღეს. ლიცენზიის გამცემმა ორგანომ უნდა გამოიკვლიოს ყველა წარდგენილი დოკუმენტი, მოუსმინოს განმცხადებელსა და ადმინისტრაციულ წარმოებაში მონაწილე სხვა დაინტერესებულ პირს, განიხილოს მაძიებლის ანდა მისი წარმომადგენლის მიერ დაყენებული შუამდგომლობები (აცილების, მტკიცებულებათა წარდგენის და ა.შ). თუ ექსპერტიზა ჰქონდა დანიშნული, უფლება აქვს სხდომაზე გამოიძახოს ექსპერტი და კითხვები დაუსვას მის მიერ წარმოდგენილ დასკვნასთან დაკავშირებით. ექსპერტისათვის კითხვის დასმის უფლება აქვს მაძიებელსა და საქმეში ჩართულ დაინტერესებულ პირსაც. სხდომაზე შიძლება გამოძახებულ იქნან მოწმეები ამა თუ იმ ფაქტის დასადასტურებლად.
ზეპირი მოსმენის სხდომა საჯაროა და ნებისმიერ პირს აქვს უფლება დაესწროს მას, თუმცა სხდომაზე გამოსვლის უფლებით სარგებლობენ მაძიებელი და დაინტერესებული პირი. სხდომაზე დგება ოქმი, სადაც აღინიშნება საქმის მიმდინარეობა, განხილვის დრო და ადგილი, სხდომაზე მონაწილე მხარეები, ექსპერტებისა და მოწმების ვინაობა, განსახილველი საკითხის მოკლე აღწერა. ოქმს ხელს აწერს სხდომის თავმჯდომარე და მდივანი.
გადაწყვეტილება ლიცენზიის გაცემის ან გაცემაზე უარის თქმის შესახებ მიიღება საქმეზე ყველა გარემოების დადგენის, მტკიცებულებების გამოკვლევის, შეფასებისა და წარმოდგენილი არგუმენტების ურთიერთშეჯერების საფუძველზე. გადაწყვეტილება ლიცენზიის გაცემის ან გაცემაზე უარის თქმის შესახებ მიიღება ინდივიდუალური ადმინისტრაციული აქტის სახით განცხადების დადგენილ მოთხოვნებთან შესაბამისობის შემოწმებიდან 1 თვის ვადაში, ზეპირი მოსმენის გამართვიდან 10 დღის ვადაში. ადმინისტრაციული აქტი შეიძლება გამოიცეს ბრძანების სახით. ადმინისტრაციული აქტი გამოიცემა წერილობით და ძალაში შედის გამოქვეყნების მომენტიდან. გამოქვეყნების მიმართ გამოიყენება იგივე წესები, რაც საჯარო გაცნობისათვის დოკუმენტების წარდგენის შესახებ ცნობის გამოქვეყნებისათვის არის დადგენილი. ლიცენზიის თაობაზე მიღებული აქტის გამოქვეყნება სავალდებულოა. კონკრეტულად თუ რა სახით იქნება ადმინისტრაციული აქტი გამოცემული, ეს დამოკიდებულია ლიცენზიის გამცემი ორგანოს დებულებაზე. ლიცენზია (სალიცენზიო მოწმობა) გაიცემა ადმინისტრაციული აქტის გამოცემიდან 3 დღის ვადაში.
ინფორმაცია ლიცენზიის გაცემის ან გაცემაზე უარის თქმის შესახებ უნდა გამოქვეყნდეს ადმინისტრაციული აქტის გამოცემიდან 10 დღის ვადაში ოფიციალურ ბეჭდვით ორგანოში - „საქართველოს საკანონმდებლო მაცნეში“. გამოსაქვეყნებელი ინფორმაცია მოიცავს მოკლე წერილობით პუბლიკაციას, სადაც იქნება აღნიშნული ლიცენზიის მფლობელის ან იმ პირის სახელწოდება, რომელსაც უარი ეთქვა ლიცენზიის გაცემაზე (ორგანიზაციულ-სამართლებრივი ფორმის მითითებით, ასეთი სუბიექტის არსებობის შემთხვევაში, მაგ., ინდ. მეწარმე, შპს, სს, სპს,), გამცემი ორგანოს დასახელება, ბრძანების ნომერი და თარიღი, რომლითაც გადაწყვეტილება იქნა მიღებული, გაცემის შემთხვევაში ლიცენზირებული საქმიანობის სახეობა და ლიცენზიის მოქმედების ვადა.
ადმინისტრაციული ორგანოს გადაწყვეტილება ლიცენზიის გაცემის, ასევე ლიცენზიის გაცემაზე უარის თქმის, მისი მოქმედების შეჩერების ან განახლების ან/და გაუქმების შესახებ წარმოადგენს ადმინისტრაციულ აქტს, რომელიც უნდა შეიცავდეს შემდეგ რეკვიზიტებს:
ადმინისტრაციული აქტის სახეს (მაგ., ბრძანება №);
გამომცემ ორგანოს დასახელებას;
ადმინისტრაციული აქტის სათაურს (მაგ., ბრძანება № ლიცენზიის გაცემის შესახებ ან ლიცენზიის გაცემაზე უარის თქმის შესახებ);
უფლებამოსილი თანამდებობის პირის გვარს, სახელსა და ხელმოწერას;
გამოცემის დროსა და ადგილს;
ადმინისტრაციული აქტის გამომცემი ორგანოს მიერ მინიჭებულ სარეგისტრაციო ნომერს;
ორგანო, რომელშიც შეიძლება ამ აქტის გასაჩივრება, მისი მისამართი და საჩივრის წარდგენის ვადა (მაგ., „ბრძანება ლიცენზიის გაცემის შესახებ შეიძლება 6 თვის ვადაში გასაჩივრდეს თბილისის საოლქო სასამართლოში“).
ადმინისტრაციული წარმოების დადგენილი ვადის დარღვევა ჩაითვლება ლიცენზიის გაცემაზე უარის თქმად, რომლის გასაჩივრებაც შესაძლებელია.
ადმინისტრაციული წარმოებისას დარღვეული ანუ გაშვებული ვადის აღდგენა შესაძლებელია, თუ ვადის გაშვება მოხდა საპატიო გარემოებების არსებობისას, როგორიცაა დაუძლეველი ძალა (მიწისძვრა, წყალდიდობა ან ა.შ.), ლიცენზიის მაძიებლის ავადმყოფობა ანდა სხვა საპატიო მიზეზი და ლიცენზიის გამცემი ორგანოს ბრალი. გაშვებული ვადის აღდგენისათვის ლიცენზიის მაძიებელმა წრილობითი განცხადებით უნდა მიმართოს საპატიო გარემოებების აღმოფხვრიდან არაუგვიანეს 15 დღეში და უნდა დაადასტუროს საპატიო გარემოებების არსებობა განცხადებაზე ავადმყოფობის ცნობის დართვით და სხვა. ლიცენზიის გამცემი ორგანო გაშვებული ვადის აღდგენის განცხადებას განიხილავს 5 დღის ვადაში და იღებს ერთ-ერთ შემდეგ გადაწყვეტილებას (ადმინისტრაციული აქტის ფორმით) ვადის აღდგენის ან ვადის აღდგენის დაუშვებლობის შესახებ.
საჯარო ადმინისტრაციული წარმოება
ლიცენზიის გაცემის თაომაზე
ს ქ ე მ ა

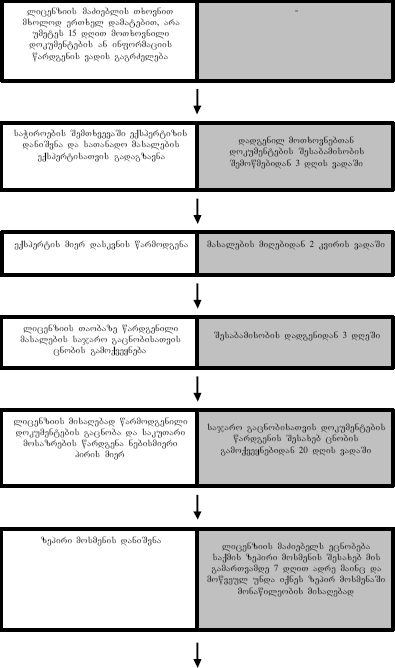
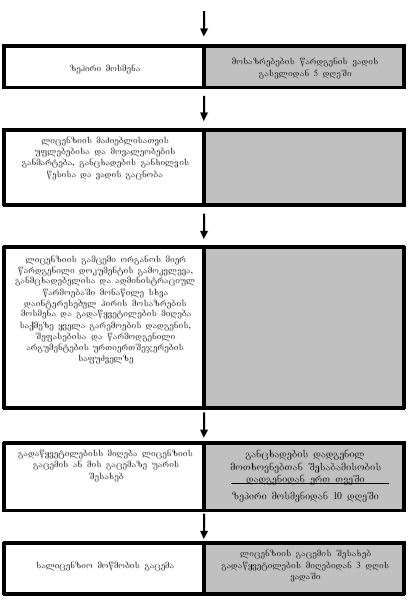
ლიცენზიის გაცემაზე უარის თქმის საფუძვლები
ლიცენზია არ გაიცემა, თუ:
ლიცენზიის მაძიებლის მიერ წარმოდგენილი დოკუმენტაცია არ აკმაყოფილებს სალიცენზიო პირობებს;
ლიცენზიის მაძიებელი ითხოვს ლიცენზიას, რომელიც გაუქმებულია და გაუქმებიდან არ გასულა ერთი წელი;
ლიცენზიის მაძიებელს შეუჩერდა ამ სფეროში მიღებული ლიცენზიის მოქმედება და არ აღმოფხვრილა ლიცენზიის შეჩერების საფუძველი.
აკრძალულია ლიცენზიის გაცემაზე უარის თქმა გასაცემი ლიცენზიების რაოდენობის შეზღუდვის მოტივით.
ნებისმიერი პირი, რომელიც აკმაყოფილებს სალიცენზიო პირობებს, უნდა გაიცეს ლიცენზია. ჯანდაცვის სფეროში სამომხმარებლო ბაზარი არ არის შეზღუდული და დაუშვებელია, რომ ლიცენზიის გამცემმა ორგანომ ჩათვალოს, რომ გარკვეული რაოდენობის ლიცენზიის მეტი არ არის საჭირო და უარი უთხრას განმცხადებელს.
სალიცენზიო მოწმობის დაკარგვა ან დაზიანება
სალიცენზიო მოწმობის დაკარგვის ან დაზიანების შემთხვევაში ლიცენზიის მფლობელი ლიცენზიის გამცემს მიმართავს წერილობითი განცხადებით სალიცენზიო მოწმობის დუბლიკატის მიღების თაობაზე.
ლიცენზიის გამცემი განცხადების მიღებიდან 2 დღეში გასცემს სალიცენზიო მოწმობის დუბლიკატს. შესაბამისი ინფორმაცია შეიტანება უწყებრივ და სახელმწიფო სალიცენზიო რეესტრში.
სალიცენზიო მოწმობის დუბლიკატს აქვს ისეთივე იურიდიული ძალა, როგორიც მის დედანს.
სალიცენზიო მოწმობის დუბლიკატის მოსაკრებელი განისაზღვრება „სალიცენზიო და სანებართვო მოსაკრებლის შესახებ“ საქართველოს კანონით და შეადგენს 10 ლარს.
დუბლიკატის გაცემასთან დაკავშირებით ლიცენზიის გამცემი ორგანო ზოგადი ადმინისტრაციული კოდექსის შესაბამისად წარმართავს მარტივ ადმინისტრაციულ წარმოებას.
ლიცენზიის დუბლიკატის გაცემასთან დაკავშირებით სახელწიფო ორგანოებისათვის ხშირ შემთხვევაში გაურკვეველია თუ რა არის ლიცენზიის დუბლიკატი: ეს არის ლიცენზიის ქსეროასლი, ლიცენზიის ახალი მოწმობა თუ სხვა რამ. გაურკვევლობას თუ ერთგვარ დაბნეულობას იწვევს ის ფაქტი, რომ სალიცენზიო მოწმობა (ლიცენზია) არის მკაცრი აღრიცხვის დოკუმენტი, რომელიც შეიცავს სპეციალურ რეკვიზიტებს (სპეციალურ ნომერ ს, გაცემის თარიღსა და ა.შ.), რომელიც განსაკუთრებული წესით ბარდება ლიცენზიის ორგანოს და პასუხისმგებელია მის თითოეულ ცალზე. ლიცენზიის დუბლიკატი არის ჩვეულებრივ ახალი სალიცენზიო მოწმობა, იმ განსხვავებით, რომ მასზე თვალსაჩინო ადგილას აღინიშნება წარწერა: „დუბლიკატი“ ან „ასლი“. რაც შეეხება ნუმერაციას: ლიცენზია წარწერით „დუბლიკატი“ იქნება ადრე დაკარგული თუ დაზიანებული ლიცენზიის შემცველი ახალი დოკუმენტი თავისი ნომრით, რომლის ნუმერაცია ბუნებრივია არ ემთხვევა დაკრგული თუ დაზიანებული ლიცენზიის ნომერს შესაძლებელია საერთოდ შემუშავდეს დუბლიკატისათვის ახალი სალიცენზიო მოწმობის ფორმა და სათანადო წესით დამტკიცდეს იგი.
ლიცენზიის მოქმედების შეჩერება და განახლება
ლიცენზიის გამცემი იღებს გადაწყვეტილებას ლიცენზიის მოქმედების შეჩერების შესახებ, თუ ლიცენზიის მფლობელი არღვევს კანონით დადგენილ სალიცენზიო პირობებს.
თუ ლიცენზიის შეჩერების შესახებ გადაწყვეტილების მიღების დაყოვნებამ შეიძლება არსებითი ზიანი მიაყენოს საჯარო ან კერძო ინტერესებს, ლიცენზიის გამცემი უფლებამოსილია ადმინისტრაციული წარმოების გარეშე მიიღოს დასაბუთებული გადაწყვეტილება ლიცენზიის მოქმედების შეჩერების შესახებ. გადაწყვეტილება ლიცენზიის მფლობელს უნდა ეცნობოს არა უგვიანეს მომდევნო სამუშაო დღისა.
ლიცენზიის გამცემი ლიცენზიის მოქმედების შეჩერების შესახებ გადაწყვეტილებაში მიუთითებს კანონით დადგენილ სალიცენზიო პირობებს, რომელთა შესრულებაც (გამოსწორებაც) გამოიწვევს ლიცენზიის მოქმედების განახლებას.
ლიცენზიის მოქმედება შეჩერდება გამომწვევი მიზეზების აღმოფხვრამდე, მაგრამ არა უგვიანეს 3 თვისა.
ლიცენზიის მოქმედების შეჩერების შესახებ გადაწყვეტილება შეიძლება გასაჩივრდეს თბილისის საოლქო სასამართლოში.
ლიცენზიის მოქმედება განახლდება ლიცენზიის განახლების შესახებ ადმინისტრაციული აქტის საფუძველზე. ლიცენზიის გამცემი უფლებამოსილია ლიცენზიის მოქმედების განახლების ადმინისტრაციული წარმოების დასრულებამდე, წარდგენილ მასალებზე დაყრდნობით, განაახლოს ლიცენზიის მოქმედება.
თუ ლიცენზიის მოქმედების შეჩერება ან ლიცენზიის გაუქმება ზიანს აყენებს, საზოგადოებრივ ან სახელმწიფო ინტერესებს, ლიცენზიის მფლობელს, კანონის საფუძველზე, უფლება აქვს გარკვეული ვადით გააგრძელოს ლიცენზიით გათვალისწინებული საქმიანობა ლიცენზიის გამცემის ზედამხედველობით.
ლიცენზიის თაობაზე გადაწყვეტილების სასამართლოში გასაჩივრება არ იწვევს არსებული გადაწყვეტილების შეჩერებას, თუ ლიცენზიის გამცემი ან სასამართლო არ მიიღებს სხვა გადაწყვეტილებას.
ლიცენზიის გაუქმება
ლიცენზიის გაცემაზე გადაწყვეტილების გაუქმების საფუძველია, თუ:
იგი გასცა არაუფლებამოსილმა ორგანომ ან პირმა;
ჯანდაცვის სფეროში ლიცენზიის გამცემი უფლებამოსილი ორგანო განისაზღვრება „სამედიცინო და ფარმაცევტული საქმიანობის შესახებ“ კანონით, ხოლო ლიცენზიის გამცემი უფლებამოსილი პირი კი, ლიცენზიის გამცემი ორგანოს დებულებით.
იგი ეწინააღმდეგება კანონს ან არსებითად ირღვევა ლიცენზიის მომზადების ან გამოცემის კანონმდებლობით დადგენილი მოთხოვნები;
ლიცენზია გაუქმდ ება, თუ იგი გაიცა ისეთ საქმიანობაზე რომელიც კანონით არის აკრძალული. ლიცენზიის გაუქმების დამოუკიდებული საფუძველია მისი გაცემის წესის არსებითი დარღვევა. კანონით პირდაპირ განისაზღვრა, რომ ლიცენზია უნდა გაიცეს საჯარო ადმინისტრაციული წარმოების წესით. საჯარო ადმინისტრაციულ წარმოებაში (ლიცენზიის გაცემის წესი) „არსებითი მოთხოვნების დარღვევად“ ითვლება თი არ გამოქვეყნდა ცნობა საჯარო გაცნობისათვის დოკუმენტის წარდგენის შესახებ, მაძიებელი და სხვა დაინტერესებული პირები არ იქნენ მოწვეული საქმის ზეპირ მოსმენაზე, მაძიებელს არ ეცნობა საქმის განხილვის ვადის გაგრძელების შესახებ, ლიცენზიის გაცემის ან გაცემაზე უარის თქმის შესახებ აქტი გამოიცა შესაბამისობის დადგენიდან 1 თვის გასვლის შემდეგ, დაირღვა მოსაზრებების წარდგენის 20 დღიანი ვადა, ადმინისრტაციული აქტი ლიცენზიის გაცემის ან გაცემაზე უარის თქმის შესახებ არ გამოქვეყნდა.
ლიცენზიის გაუქმება პირდაპირ მითითებულია კანონში;
არსებობს ახლად აღმოჩენილი ან ახლად გამოვლენილი გარემოება, აგრეთვე შესაბამისი სამეცნიერო-ტექნიკური აღმოჩენა ან გამოგონება, რაც ლიცენზიის გამცემს ართმევს შესაძლებლობას გამოსცეს ასეთი ადმინისტრაციული აქტი და ლიცენზიის მოქმედებამ (საქმიანობამ) შეიძლება მნიშვნელოვანი ზიანი მიაყენოს სახელმწიფო ან საზოგადოებრივ ინტერესებს;
არსებობს ლიცენზიის მფლობელის მოთხოვნა;
სახეზეა ლიცენზიის მფლობელის გარდაცვალება (დადგენილი წესით გარდაცვლილად ან უგზო-უკვლოდ დაკარგულად აღიარება ან ქმედუუნაროდ ცნობა) ანდა ლიკვიდაცია;
ლიცენზიის მფლობელის გარდაცვლილად გამოცხადების, უგზოუკვლოდ დაკარგულად აღიარების, ქმედუუნარობის აღიარების ან ლიკვიდაციის საფუძვლით ლიცენზია გაუქმდება მაშინ, თუ წარმოდგენილი იქნება თითოეული ამ საფუძვლის შესახებ სასამართლო გადაწყვეტილება; თითოეული ზემოაღნიშნული ფაქტი (ლიცენზიის მაძიებლის გამოცხადება, ქმედუუნაროდ აღიარება, უგზო-უკვლოდ დაკარგულად აღიარება, ხოლო იურიდიული პირის შემთხვევაში კი - ლიკვიდაცია) დადგენილი უნდა იყოს სასამართლოს მიერ.
ლიცენზიის მოქმედების შეჩერების ვადა გასულია და არ აღმოიფხვრა მისი შეჩერების საფუძველი;
სალიცენზიო პირობების დარღვევისას ლიცენზიის გამცემი ორგანო აჩერებს ლიცენზიის მოქმედებას არაუმეტეს 3 თვის ვადით. ამ ვადაში დარღვეული სალიცენზიო პირობების გამოუსწორებლობა იქნება ლიცენზიის გაუქმების საფუძველი.
გაუქმდა ან შეიცვალა შესაბამისი ნორმატიული აქტი, რაც ადმინისტრაციულ ორგანოს ართმევს შესაძლებლობას გამოსცეს ასეთი ადმინისტრაციულ-სამართლებრივი აქტი და ადმინისტრაციული აქტის მოქმედებამ შეიძლება მნიშვნელოვანი ზიანი მიაყენოს სახელმწიფო ან საზოგადოებრივ ინტერესებს. ასეთ შემთხვევაში, დაინტერესებულ მხარეს, რომელსაც ზიანი მიადგა, მისი მოთხოვნის საფუძველზე მიეცემა ანაზღაურება.
ლიცენზიის გამცემი ლიცენზიის გაუქმების შესახებ გადაწყვეტილებას იღებს ლიცენზიის გაცემისათვის დადგენილი წესით.
თუ ლიცენზიის მოქმედების შეჩერების ვადის გასვლისას არ აღმოიფხვრა მისი შეჩერების საფუძველი და თუ გადაწყვეტილების მიღების დაყოვნებამ შეიძლება არსებითი ზიანი მიაყენოს საჯარო ან კერძო ინტერესებს, ლიცენზიის გამცემი ვალდებულია 3 დღეში მიიღოს დას აბუთებული გადაწყვეტილება ლიცენზიის გაუქმების შესახებ. ლიცენზიის გამცემი ლიცენზიის მფლობელს დაუყოვნებლივ შეატყობინებს ლიცენზიის გაუქმების თაობაზე ადმინისტრაციული წარმოების დაწყების შესახებ.
სალიცენზიო მოწმობა გამცემს უნდა დაუბრუნდეს ლიცენზიის გაუქმების შესახებ გადაწყვეტილების ძალაში შესვლიდან 3 დღის ვადაში.
ავტონომიურ რესპუბლიკებში ლიცენზიების გაცემის წესი
ლიცენზიას ფარმაცევტული საქმიანობის სფეროში გასცემენ საქართველოს შრომის, ჯანმრთელობისა და სოციალური დაცვის სამინისტროს სისტემაში შემავალი ავტონომიური რესპუბლიკის შესაბამისი სამინისტროები2, რომელთაც სამედიცინო საქმიანობაზე ლიცენზიის გაცემის უფლებამოსილება გადაეცემათ 2005 წლის 1 იანვრიდან (საქართველოს პრეზიდენტის 6 ნოემბრის, №551 ბრძანებულება _ „საქართველოს აღმასრულებელი ხელისუფლების სამთავრობო დაწესებულებების სისტემაში ავტონომიური რესპუბლიკის შესაბამისი სამინისტროებისა და უწყებებისათვის ლიცენზიებისა და ნებართვების გაცემის წესის შესახებ“ საქართველოს პრეზიდენტის 2003 წლის 29 სექტემბრის №472 ბრძანებულებაში დამატების შეტანის თაობაზე).
თუ განცხადება ლიცენზიის მაძიებლის მიერ წარდგენილია საქართველოს შრომის, ჯანმრთელობისა და სოციალური დაცვის სამინისტროში, სამინისტრო ვალდებულია განცხადება თანდართული დოკუმენტებით 3 დღეში გადაუგზავნოს ავტონომიური რესპუბლიკის ჯანმრთელობის დაცვის სამინისტროს. რის შესახებაც უნდა ეცნობოს ლიცენზიის მაძიებელს შესაბამისი დასაბუთებით, საბუთების გადაგზავნიდან 2 დღეში.
ლიცენზიის გაცემის თაობაზე ადმინისტრაციული წარმოების დაწყების შესახებ ავტონომიური რესპუბლიკის ჯანმრთელობის დაცვის სამინისტრო აცნობებს საქართველოს შრომის, ჯანმრთელობისა და სოციალური დაცვის სამინისტროს. ეს პროცედურა ხორციელდება წერილობითი განცხადების მიღებიდან 3 დღეში, ლიცენზიის მაძიებლის მიერ წარდგენილი დოკუმენტების სათანადოდ დამოწმებული ასლებით.
ავტონომიური რესპუბლიკის ჯანმრთელობის დაცვის სამინისტრო ვალდებულია ლიცენზიის თაობაზე მიღებული გადაწყვეტილების შესახებ და უწყებრივ რეესტრში მონაცემების შეტანიდან 10 დღის ვადაში აცნობოს საქართველოს შრომის, ჯანმრთელობისა და სოციალური დაცვის სამინისტროს.
__________________________________
შენიშვნა: აფხაზეთის ავტონომიური რესპუბლიკის ჯანმრთელობის დაცვის სამინისტროს ლიცენზიის გაცემის უფლებამოსილება გადაეცემა აფხაზეთის ტერიტორიაზე საქართველოს იურისდიქციის სრულად აღდგენის შემდეგ.
__________________
1 პასპორტები იხილეთ საქართველოს ახალგაზრდა ეკონომისტთა ასოციაციის ინტერნეტ გვერდზე: www.economists.ge/
2 საქართველოს პრეზიდეტის 2003 წლის 29 სექტემბრის №472 ბრძანებულება.
 |
4 ნებართვა |
▲back to top |
ნებართვის სახეები
სამკურნალო საშუალებების, ფარმაცევტული სუბსტანციებისა და დაუფასოებელი ფარმაცევტული პროდუქციის იმპორტისა და რეექსპორტის, სპეციალურ კონტროლს დაქვემდებარებული სამკურნალო საშუალებების იმპორტის და ექსპორტის შემთხვევაში აუცილებელია მეწარმეს ჰქონდეს შრომის, ჯანმრთელობისა და სოციალური დაცვის სამინისტროს მიერ გაცემული ნებართვა პროდუქციის ნომენკლატურის მიხედვით.
სანებართვო სახეობა |
მოსაკრებლს |
სამკურნალო საშუალებების, ფარმაცევტული სუბსტანციებისა და დაუფასოებელი ფარმაცევტული პროდუქციის იმპორტი |
100 ლარი |
სამკურნალო საშუალებების, ფარმაცევტული სუბსტანციებისა და დაუფასოებელი ფარმაცევტული პროდუქციის რეექსპორტი |
100 ლარი |
სპეციალურ კონტროლს დაქვემდებარებული სამკურნალო საშუალებების იმპორტი |
100 ლარი |
სპეციალურ კონტროლს დაქვემდებარებული სამკურნალო საშუალებების ექსპორტი |
100 ლარი |
განცხადება ნებართვის მისაღებად. სანებართვო პირობები
სამკურნალო საშუალებების, ფარმაცევტული სუბსტანციებისა და დაუფასოებელი ფარმაცევტული პროდუქციის იმპორტისა და რეექსპორტის, სპეციალურ კონტროლს დაქვემდებარებული სამკურნალო საშუალებების იმპორტის და ექსპორტის, ნებართვის მისაღებად მაძიებელი განცხადებით მიმართავს საქართველოს შრომის, ჯანმრთელობისა და სოციალური დაცვის სამინისტროს.
განცხადებაში აღინიშნება:
ნებართვის გამცემი ორგანოს დასახელება, რომელსაც მიმართავს განმცხადებელი;
განმცხადებლის ვინაობა და მისამართი (სამეწარმეო რეესტრის მონაცემები);
თუ რომელი ნებართვის მიღებას მოითხოვს მაძიებელი (განსახორციელებელი ოპერაციის მოცულობა);
განცხადების წარდგენის თარიღი და განმცხადებლის ხელმოწერა;
თანდართული საბუთების ნუსხა.
განცხადებას უნდა დაერთოს:
- სანებართვო მოსაკრებლის გადახდის დამადასტურებელი საბუთი.
- ხარისხის სერტიფიკატი;
- ინფორმაცია პროდუქციის ნომენკლატურის, რაოდენობის, ერთეულის ფასის, თანხის, სახელმწიფო რეგისტრაციის ნომრის, გარდა „წამლისა და ფარმაცევტული საქმიანობის შესახებ“ კანონით დაშვებული გამონაკლისებისა, მომწოდებლისა და/ან მიმღების დასახელების და მისამართის, მწარმოებლისა და მწარმოებელი ქვეყნის, საიდენტიფიკაციო კოდის და საბაჟოს დასახელების შესახებ;
- შესაბამისი ლიცენზიის (ფარმაცევტული ბაზის/საწარმოს) მოწმობის ასლი;
- მომწოდებელთან გაფორმებული ხელშეკრულება შესაბამისი სპეციფიკის ამსახველი დანართით;
- წინასწარი ნებართვის ასლი, ნარკოტიკული საშუალებების და ფსიქოტროპული ნივთიერებების იმპორტისა და ექსპორტის შემთხვევაში.
ნებართვა გაიცემა მხოლოდ რეგისტრირებულ სამკურნალო საშუალებებზე, გარდა კანონით გათვალისწინებული გამონაკლისებისა.
ნებართვის მისაღებად სხვა პირობების დაწესება აკრძალულია.
ნებართვის მიღების შემდეგ განცხადებაში მითითებული ინფორმაციის ცვლილების შემთხვევაში, ნებართვის მფლობელი ვალდებულია ნებართვის გამცემს წერილობით აცნობოს ამის თაობაზე და წარუდგინოს სათანადო დოკუმენტები შესაბამისი ცვლილების განხორციელებიდან 7 სამუშაო დღეში. რეესტრული მონაცემების ისეთი ცვლილება, რომელიც დაფიქსირებულია ნებართვაში (მაგ., ნებართვის მფლობელი სუბიექტის სახელწოდების შეცვლა), მოითხოვს ახალი სანებართვო მოწმობის გაცემას, თუმცა აღნიშნულზე მოსაკრებელი არ არის დაწესებული.
ნებართვის გაცემის წესი
ნებართვის გაცემის ან მის გაცემაზე უარის თქმის შესახებ გადაწყვეტილებას ნებართვის გამცემი ორგანო იღებს მარტივი ადმინისტრაციული წარმოების წესით. თუ ნებართვის გაცემა ეხება პირთა ფართო წრის ინტერესებს, ნებართვის გამცემი ორგანო უფლებამოსილია ნებართვა გასცეს საჯარო ადმინისტრაციული წარმოების წესით (ლიცენზ იის გაცემის წესის ანალოგიურად).
საქმის წარმოება იწყება ჩვეულებრივ წერილობითი განცხადებისა და მასზე თანდართული მასალების წარდგენით ნებართვის გამცემ ორგანოში. განცხადება ნებართვის გამცემი ორგანოს კანცელარიის მიერ რეგისტრაციაში ტარდება მიღებისთანავე და დაესმება მას რეგისტრაციის თარიღი და ნომერი.
თავდაპირველად ნებართვის გამცემი ორგანო განცხადების რეგისტრაციიდან 3 დღის ვადაში ამოწმებს აკმაყოფილებს თუ არა წარმოდგენილი განცხადება და მასზე თანდართული მასალა დადგენილ მოთხოვნებს ანუ სანებართვო პირობებს, რომლებიც დადგენილია მხოლოდ კანონით. ადმინისტრაციული წარმოების ეს საფეხური გულისხმობს იმის შემოწმებას, რომ განცხადება შეესაბამება თუ არა ზოგადი ადმინისტრაციული კოდექსის 78-ე და „სამეწარმეო საქმიანობის ლიცენზიისა და ნებართვის გაცემის საფუძვლების შესახებ“ კანონის 22-ე მუხლის მოთხოვნებს; ასევე, უნდა შემოწმდეს განცხადებაზე თანდართული მასალები შეესაბამება თუ არა „წამლისა და ფარმაცევტული საქმიანობის შესახებ“ კანონის მე-18 მუხლის მოთხოვნებს და ერთვის თუ არა მას სანებართვო მოსაკრებლის გადახდის დამადასტურებელი ქვითარი. შესაბამისობის შემოწმებისას დგინდება შემდეგი გარემოებები:
1. განცხადება ან მასზე დართული მასალები ხომ არ არის წარმოდგენილი უცხო ენაზე. თუ რომელიმე დოკუმენტი ან შემდგომ მოთხოვნილი დოკუმენტი ქართულ ენაზე არ არის წარმოდგენილი ნებართვის გამცემმა ორგანომ მაძიებელს უნდა განუსაზღვროს ვადა დოკუმენტის თარგმნისა და მისი სანოტარო წესით დადასტურებისათვის, რომელიც არ შეიძლება იყოს 3 დღეზე ნაკლები;
2. თუ განმცხადებლის მიერ მოთხოვნილი ნებართვის გაცემა მიეკუთვნება სხვა ორგანოს უფლებამოსილებას, ადმინისტრაციული ორგანო ვალდებულია არა უგვიანეს 5 დღისა გადაუგზავნოს განცხადება და მასზე თანდართული საბუთები უფლებამოსილ ადმინისტრაციულ ორგანოს, რომლის შესახებაც 2 დღის ვადაში შესაბამისი დასაბუთებით აცნობებს განმცხადებელს;
3. საქმისწარმოების ვადის გაგრძელების აუცილებლობა. უნდა აღინიშნოს, რომ ვადის 3 თვემდე გაგრძელება არის მაქსიმუმი (რომელშიც მიეთვლება 15 დღიანი ვადაც) და ვადის გაგრძელებისას ნებართვის გამცემმა უნდა იხელმძღვანელოს საქმის სირთულით, სავარაუდოდ რა ვადაში შეძლებს გადაწყვეტილების მიღებას და იგი შეიძლება იყოს თვენახევარი, ორი თვე ან 15 დღით გაგრძელება და ა.შ. ვადის გაგრძელების შესახებ გადაწყვეტილება უნდა იქნეს მიღებული ადმინისტრაციული აქტის (მაგ., ბრძანების) ფორმით, რომლის გამოცემისათვის ცალკე ადმინისტრაციული წარმოება არ იმართება. ადმინისტრაციული აქტი უნდა შეიცავდეს დასაბუთებას, თუ რატომ გახდა აუცილებელი ვადის გაგრძელება და იგი მიიღება არაუგვიანეს 3 დღისა განცხადების რეგისტრაციიდან. ვადის გაგრძელების შესახებ ადმინისტრაციული აქტის მიღებიდან არაუგვიანეს მომდევნო დღეს უნდა ეცნობოს მაძიებელს, რომ ვადა გაგრძელებულია და გადაეცეს მას ვადის გაგრძელების შესახებ ადმინისტრაციული აქტის ასლი;
4. თუ დადგენილი დოკუმენტები არ იქნა წარდგენილი, მაშინ ნებართვის გამცემმა ორგანომ უნდა მოსთხოვოს განმცხადებელს წარადგინოს აუცილებელი დოკუმენტები და განუსაზღვროს მათი წარდგენისათვის 3 დღიანი ვადა. მოთხოვნაში კონკრეტულად უნდა მიეთითოს თუ რა დოკუმენტი ან ინფორმაცია უნდა წარმოადგინოს მაძიებელმა, წინააღმდეგ შემთხვევაში მისთვის განსაზღვრული ვადა გასულად არ ითვლება და მისი ათვლა დაიწყება მოთხოვნის დაკონკრეტებისას. თუ ამ ვადაში არ იქნა წარდგენილი დოკუმენტები, ნებართვის გამცემ ორგანოს უფლება აქვს (მაგრამ არ არის ვალდებული) განმცხადებლის მოთხოვნით მხოლოდ ერთხელ, არა უმეტეს 15 დღით დამატებით გააგრძელოს დოკუმენტების წარმოდგენის ვადა. დამატებით მოთხოვნილი დოკუმენტების წარუდგენლობა იწვევს ნებართვის მოთხოვნის შესახებ განცხადების განუხილველად დატოვებას. დოკუმენტების წარსადგენად განმცხადებლისათვის მიცემული დამატებითი ვადა არ მიეთვლება საქმისწარმოების საერთო ვადაში, ე.ი. მოცემულ შემთხვევაში საქმისწარმოება შეჩერებულია. ვადის დინება განახლდება შესაბამისი დოკუმენტების წარდგენიდან, დოკუმენტების წარმოუდგენლობისას კი, განცხადება რჩება განუხილველი. თუ მეწარმე დამატებით განსაზღვრულ ვადაში ვერ ახერხებს მოთხოვნილი დოკუმენტაციის წარმოდგენას და განცხადების განუხილველად დატოვებით არ დაკარგოს მოსაკრებელი, სასურველია წარმოადგინოს წერილობითი განცხადება ნებართვის მისაღებად შეტანილი დოკუმენტაციის უკან გატანის შესახებ. ამის შემდეგ, მეწარმეს უფლება აქვს აღმოფხვრას ხარვეზი და იგივე დოკუმენტაცია კვლავ შეიტანოს ნებართვის გამცემ ორგანოში;
5. ექსპერტიზის დანიშვნის აუცილებლობა. ცალკეულ შემთხვევებში, როდესაც წამოიჭრება ისეთი საკითხები, რომლებიც სპეციალურ ცოდნას მოითხოვს და გადაწყვეტილების მიღება შეუძლებელი ხდება ამ საკითხების გარკვევის გარეშე, ნებართვის გამცემი ნიშნავს ექსპერტიზას.
ნებართვის გამცემი ორგანო ვალდებულია განცხადების დადგენილ მოთხოვნებთან შესაბამისობის შემოწმებიდან 3 დღის განმავლობაში განცხადებისა და მასზე თანდართული დოკუმენტების ასლები გადაუგზავნოს ექსპერტს. ექსპერტი დასკვნას წარადგენს 7 დღის ვადაში, თუმცა მისი წარუდგენლობა არ დააბრკოლებს განცხადების განხილვასა და გადაწყვეტილების მიღებას. განსაკუთრებულ შემთხვევებში, როცა 7 დღეში დასკვნის წარდგენა შეუძლებელია და საქმის გარემოებების გათვალისწინებით დასკვნის გარეშე გადაწყვეტილების გამოტანა მიზანშეუწონელია, ნებართვის გამცემი უფლებამოსილია, ხოლო დაინტერესებული მხარის მოთხოვნის შემთხვევაში ვალდებულია დასკვნის წარდგენის ვადა გააგრძელოს არაუმეტეს 7 დღით. დაინტერესებული მხარე უფლებამოსილია გაასაჩივროს ეს გადაწყვეტილება. ექსპერტიზის მიმდინარეობისას ვადის დინება შეჩერებულია.
ნებართვის მიღებისას ადმინისტრაციულ წარმოებაში პირი მონაწილეობს პირადად ან წარმომადგენლის მეშვეობით, რომლის მიმართაც იგივე წესები გამოიყენება, რაც ლიცენზიის მიღების შესახებ ადმინისტრაციული წარმოებისას იყო აღნიშნული. ანალოგიურად გამოიყენება ამ ადმინისტრაციულ წარმოებაში მონაწილე თანამდებობის პირთა აცილების წესი.
ნებართვის გაცემის თაობაზე ადმინისტრაციულ წარმოებაში მიწვეული უნდა იქნეს განმცხადებელი; მას უნდა მიეცეს შესაძლებლობა გამოთქვას თავისი მოსაზრება (მათ შორის, წერილობით) გაეცნოს საქმის მასალებს, გადაიღოს მათი ასლები, წარმოადგინოს მტკიცებულებები, დააყენოს შუამდგომლობები. ნებართვის გამცემი ორგანო ვალდებულია განმცხადებელს განუმარტოს მისი უფლება-მოვალეობები, გააცნოს საქმის განხილვის წესი და ვადები.
ნებართვის გამცემი ორგანო იკვლევს წარმოდგენილ მტკიცებულებებს, უსმენს მხარეებს, განიხილავს დაყენებულ შუამდგომლობებს, გამოძახებული მოწმეებისა და ექსპერტისაგან იღებს ახსნა-განმარტებებს, რის შემდეგაც იღებს გადაწყვეტილებას ნებართვის გაცემის ან მის გაცემაზე უარის შესახებ. ნებართვის თაობაზე ადმინისტრაციული აქტი უნდა გამოიცეს განცხადების წარდგენიდან (რეგისტრაციიდან) 15 დღის ვადაში.
საქმის განხილვისას თუ გამოვლინდება ისეთი გარემოებები, რამაც შეიძლება გამოიწვიოს ნებართვის გაცემაზე უარის თქმა, ნებართვის გაცემაზე უარის თქმის შესახებ ადმინისტრაციული აქტის გამოცემამდე ადმინისტრაციული ორგანო ვალდებულია მისცეს განმცხადებელს განცხადების უარმყოფელ გარემოებათა შესახებ საკუთარი აზრის წარდგენის შესაძლებლობა, თუ:
1. უარი ეფუძნება ინფორმაციას განმცხადებლის შესახებ (მაგ., საქმისწარმოებისას გამოვლინდა, რომ განცხადება წარმოდგენილია არარსებული სუბიექტის მიერ ან არასწორია რეესტრული მონაცემები);
2. ინფორმაცია, რომელსაც ეფუძნება უარი, განსხვავდება განმცხადებლის მიერ წარმოდგენილი ინფორმაციისაგან.
ამ გარემოებათა შესახებ საკუთარი მოსაზრებისას განმცხადებელი ნებართვის გამცემს 3 დღის ვადაში წარუდგენს. მისი წარდგენა არ არის საჭირო, როცა მოცემულ საკითხზე განმცხადებელს უკვე წარდგენილი აქვს საკუთარი მოსაზრება, აგრეთვე გადაუდებელ შემთხვევაში, როცა ადმინისტრაციული აქტის გამოცემის დაყოვნებამ შეიძლება არსებითი ზიანი მიაყენოს საჯარო ინტერესს. ასეთ შემთხვევაში ადმინისტრაციული ორგანო ვალდებულია მიუთითოს, თუ რა გადაუდებელი გარემოება არსებობს.
თუ განმცხადებელს უარი ეთქვა ნებართვის მიღებაზე, მას ხელმეორედ იმავე მოთხოვნით განცხადების შეტანა შეუძლია მხოლოდ მაშინ, თუ აღმოიფხვრება ის გარემოემა, რაც გახდა ნებართვის გაცემაზე უარის თქმის საფუძველი ან შეიცვლება ფაქტობრივი ან სამართლებრივი მდგომარეობა, რომელიც საფუძვლად დაედო ადმინისტრაციული აქტის გამოცემას ანდა თუ არსებობს ახლად აღმოჩენილი ან ახლად გამოვლენილი გარემოებები (მტკიცებულებები), რომლებიც განაპირობებენ განმცხადებლისათვის უფრო ხელსაყრელ ადმინისტრაციული აქტის გამოცემას. ფაქტობრივი გარემოებების შეცვლა სახეზეა, როდესაც ნებართვის გამცემი ორგანოსათვის ხელმეორედ მიმართვისას განმცხადებლის ფაქტობრივი მდგომარეობა შეცვლილია: მატერიალურტექნიკური ბაზა, ტექნოლოგიურ პროცესზე პასუხისმგებელი პერსონალი, დოკუმენტაცის სრულყოფილება და ა.შ. რაც ადრე რომ ჰქონოდა მაძიებელს, მასზე გაიცემოდა ნებართვა; სამართლებრივი მდგომარეობის შეცვლა უკავშირდება საკანონმდებლო ცვლილებებს - იმ პირობას, რომელსაც განმცხადებელი ადრე ვერ აკმაყოფილებდა, საკანონმდებლო ცვლილებების შემდეგ აკმაყოფილებს ანდა ცვლილებების შედეგად ესა თუ ის პირობა საერთოდ ამოღებულ იქნა კანონიდან, რაც გაცილებით უფრო ადვილს ხდის ნებართვის მიღებას. რაც შეეხება ახლად აღმოჩენილ ან ახლად გამოვლენილ გარემოებებს, ეს დამოკიდებულია კონკრეტულ შემთხვევაზე, რაიმე მტკიცებულების გამოვლენაზე, რომელიც ნებართვის გაცემის პროცესში რომ ყოფილიყო წარმოდგენილი, ნებართვა გაიცემოდა ანდა ნებართვის გაცემასთან დაკავშირებით კონკრეტულ საქმეზე დადგინდა ნებართვის გამცემი ორგანოს წარმომადგენელთა დანაშაულებრივი ქმედება, რამაც შეუშალა ხელი ნებართვის კონკრეტულ სუბიექტზე გაცემას.
ადმინისტრაციული ორგანოს გადაწყვეტილება ნებართვის გაცემის ან მის გაცემაზე უარის შესახებ წარმოადგენს ადმინისტრაციულ აქტს, რომელიც უნდა შეიცავდეს შემდეგ რეკვიზიტებს:
ადმინისტრაციული აქტის სახეს;
გამომცემ ორგანოს დასახელებას;
აქტის სათაურს;
უფლებამოსილი თანამდებობის პირის გვარს, სახელსა და ხელმოწერას;
გამოცემის დროსა და ადგილს;
გამომცემი ორგანოს მიერ მინიჭებულ სარეგისტრაციო ნომერს;
ორგანო, რომელშიც შეიძლება გასაჩივრება, მისი მისამართი და საჩივრის წარდგენის ვადა.
ადმინისტრაციული აქტი ნებართვის თაობაზე გამოიცემა წერილობით, ხოლო გადაუდებელ შემთხვევაში კი, ზეპირადაც. ეს ისეთი შემთხვევაა, როცა დაყოვნებამ შეიძლება ზიანი მიაყენოს სახელმწიფო, საზოგადოებრივ ან პირის კანონით დაცულ ინტერესს. ზეპირი სახით გამოცემული აქტი ზეპირი გამოცემიდან 3 დღის ვადაში გამოიცემა წერილობითი ფორმით. მიუხედავად ადმინისტრაციული აქტის ზეპირი ფორმისა, მის საფუძველზე გაცემული ნებართვა წერილობითი დოკუმენტია.
ადმინისტრაციული აქტი ნებართვის გაცემის ან გაცემაზე უარის თქმის შესახებ ძალაში შედის განმცხადებლისათვის გადაცემის მომენტიდან.
მარტივი ადმინისტრაციული წარმოება ნებართვის გაცემის თაობაზე
ს ქ ე მ ა



ნებართვის გაცემაზე უარის თქმის საფუძვლები
ნებართვა არ გაიცემა, თუ:
წარდგენილი დოკუმენტაცია და/ან წარმოების ფაქტობრივი მდგომარეობა არ აკმაყოფილებს სანებართვო პირობებს;
მაძიებელი მოითხოვს ისეთ ნებართვას, რომელიც მას გაუუქმდა და გაუქმებიდან არ გასულა 6 თვე;
მაძიებელს შეუჩერდა ნებართვის მოქმედება და არ აღმოფხვრილა მისი შეჩერების საფუძველი.
აკრძალულია ნებართვის გაცემაზე უარის თქმა გასაცემი ნებართვის რაოდენობის შეზღუდვის მოტივით.
გადაწყვეტილება ნებართვის გაცემაზე უარის თქმის შესახებ შეიძლება გასაჩივრდეს თბილისის საოლქო სასამართლოში.
სანებართვო მოწმობის დაკარგვის ან დაზიანების შემთხვევაში ნებართვის მფლობელი ნებართვის გამცემს მიმართავს წერილობითი განცხადებით სანებართვო მოწმობის დუბლიკატის გაცემის თაობაზე.
ნებართვის დუბლიკატის მისაღებად საჭირო არის მხოლოდ წერილობითი განცხადება.
განცხადების მიღებიდან 2 დღეში ნებართვის გამცემი გასცემს სანებართვო მოწმობის დუბლიკატს. დუბლიკატის გაცემისათვის გადასახდელი მოსაკრებელი შეადგენს 10 ლარს1.
სანებართვო მოწმობის დუბლიკატს აქვს ისეთივე იურიდიული ძალა, როგორიც მის დედანს.
ნებართვა გაიცემა ერთჯერადად და მოქმედებს კონკრეტული ოპერაციის განხორციელების ვადით.
„კონკრეტული ოპერაციის განხორციელების ვადაში“ არ იგულისხმება ნებართვაში რაიმე ვადის მითითება, თუმცა ოპერაციის განხორციელება უნდა მოხდეს წამლის რეგისტრაციის ვადის გასვლამდე. შინაარსობრივად ეს დებულება გულისხმობს კონკრეტული ოპერაციის განხორციელების უფლებას და არა ვადას, რადგანაც ნებართვა გაიცემა ერთჯერადად და არა რაიმე ვადით.
აკრძალულია იმ სამკურნალო საშუალებების იმპორტი, რომელთაც გაუვიდათ რეგისტრაციის ვადა2.
აკრძალულია ნებართვის სხვა პირთათვის გადაცემა3.
ნებართვის მოქმედების შეჩერება
ნებართვის გამცემი იღებს გადაწყვეტილებას ნებართვის მოქმედების შეჩერების შესახებ, თუ ნებართვის მფლობელი არღვევს სანებართვო პირობებს.
ნებართვის მოქმედების შეჩერების შესახებ გადაწყვეტილებას ნებართვის გამცემი იღებს ამ ნებართვის გაცემისათვის დადგენილი წესით.
გადაუდებელ შემთხვევაში, როდესაც გადაწყვეტილების მიღების დაყოვნებამ შეიძლება არსებითი ზიანი მიაყენოს საჯარო ან კერძო ინტერესებს, ნებართვის გამცემი უფლებამოსილია მიიღოს ნებართვის მოქმედების შეჩერების შესახებ დასაბუთებული გადაწყვეტილება დადგენილი ვადის დაუცველად და ამის თაობაზე ადმინისტრაციული წარმოების დაწყების შესახებ დაუყოვნებლივ უნდა აცნობოს ნებართვის მფლობელს.
ნებართვის მოქმედების შეჩერების შესახებ გადაწყვეტილებაში უნდა მიეთითოს, რომელი სანებართვო პირობაა დარღვეული. თუ ნებართვის მფლობელი 3 თვის განმავლობაში გამოასწორებს დარღვეულ სანებართვო პირობას, იგი მიმართავს ნებართვის გამცემს ნებართვის მოქმედების განახლების მოთხოვნით. განცხადებაში მეწარმე უფლებამოსილია დასვას შუამდგომლობა ადმინისტრაციული წარმოების დასრულებამდე ნებართვის მოქმედების განახლების თაობაზე გადაწყვეტილების გამოცემის შესახებ.
გადაწყვეტილება ნებართვის მოქმედების შეჩერების ან განახლების შესახებ შეიძლება გასაჩივრდეს თბილისის საოლქო სასამართლოში.
ნებართვის გაუქმება
ნებართვის გაუქმების საფუძველია, თუ:
ნებართვა გასცა არაუფლებამოსილმა ორგანომ ან პირმა;
იგი ეწინააღმდეგება კანონს, ან არსებითად დარღვეულია მისი მომზადების ან გამოცემის კანონმდებლობით დადგენილი მოთხოვნები;
არსებობს ახლად აღმოჩენილი ან ახლად გამოვლენილი გარემოება, აგრეთვე შესაბამისი სამეცნიერო-ტექნიკური აღმოჩენა ან გამოგონება, რაც ნებართვის გამცემს ართმევს შესაძლებლობას გამოსცეს ასეთი ადმინისტრაციული აქტი და ნებართვის მოქმედებამ შეიძლება მნიშვნელოვანი ზიანი მიაყენოს სახელმწიფო ან საზოგადოებრივ
ინტერესებს;
ნებართვის მფლობელის მიერ არ სრულდება ადმინისტრაციულსამართლებრივი აქტით დადგენილი ვალდებულებები;
გაუქმდა ან შეიცვალა შესაბამისი ნორმატიული აქტი, რაც ნებართვის გამცემს ართმევს შესაძლებლობას გამოსცეს ასეთი ადმინისტრაციულსამართლებრივი აქტი და ადმინისტრაციული აქტის მოქმედებამ შეიძლება მნიშვნელოვანი ზიანი მიაყენოს სახელმწიფო ან საზოგადოებრივ ინტერესებს. ამ შემთხვევაში დაინტერესებულ მხარეს, რომელსაც ზიანი მიადგა, მისი მოთხოვნის საფუძველზე მიეცემა ანაზღაურება;
ამას მოითხოვს ნებართვის მფლობელი;
სახეზეა ნებართვის მფლობელის გარდაცვალება (დადგენილი წესით გარდაცვლილად ან უგზო-უკვლოდ დაკარგულად აღიარება ან ქმედუუნაროდ ცნობა) და/ან ლიკვიდაცია;
გავიდა ნებართვის მოქმედების შეჩერების ვადა და ამ ვადაში არ აღმოიფხვრა მისი შეჩერების საფუძველი.
_________________
1. „სალიცენზიო და სანებართვო მოსაკრებლის შესახებ“ კანონი;
2. „წამლისა და ფარმაცევტული საქმიანობის შესახებ“ კანონი;
3. ნებართვის გადაცემაში იგულისხმება სანებართვო მოწმობის გასხვისება.
 |
5 გასაჩივრების წესი |
▲back to top |
ლიცენზიის/ნებართვის გაცემის ან გაცემაზე უარის თქმის შესახებ, მათი მოქმედების შეჩერების ან განახლების და/ან გაუქმების შესახებ გადაწყვეტილება (ადმინისტრაციული აქტი) შეიძლება გასაჩივრდეს თბილისის საოლქო სასამართლოში.
საქმის მწარმოებელი თანამდებობის პირების მოქმედება ან უმოქმედობა შეიძლება გასაჩივრდეს ზემდგომ ადმინისტრაციულ ორგანოში (თანამდებობის პირთან) ან შესაბამის რაიონულ სასამართლოში, კერძოდ:
განმცხადებელს უფლება აქვს, ზემდგომ ადმინისტრაციულ ორგანოში (საქმის მწარმოებელი თანამდებობის პირების მოქმედება ან უმოქმედობა) გადაწყვეტილების გასაჩივრების გარეშე, პირდაპირ მიმართოს სასამართლოს.
თუ განმცხადებელი ფიზიკური პირი გადაწყვეტილებას ჯერ გაასაჩივრებს ზემდგომ ადმინისტრაციულ ორგანოში და შემდგომ წარადგენს სარჩელს სასამართლოში, იგი თავისუფლდება სახელმწიფო ბაჟისაგან.
აკრძალულია დაწესდეს სახელმწიფო ბაჟი ან რაიმე გადასახადი ადმინისტრაციული საჩივრის განხილვისათვის.
სამინისტროში გასაჩივრება
ადმინისტრაციული საჩივარი უნდა იყოს წერილობითი ფორმის, სადაც აღინიშნება:
ა) ადმინისტრაციული ორგანოს (თანამდებობის პირის) დასახელება, სადაც შეიტანება საჩივარი;
ბ) საჩივრის წარმდგენი პირის ვინაობა და მისამართი;
გ) იმ ორგანოს (თანამდებობის პირის) დასახელება, რომლის გადაწყვეტილება (მოქმედება ან უმოქმედობა) საჩივრდება;
დ) გასაჩივრებული გადაწყვეტილების (მოქმედება ან უმოქმედობა) დასახელება;
ე) მოთხოვნა;
ვ) გარემოებები, რომლებსაც მოთხოვნა ეფუძნება;
ზ) საჩივარზე თანდართული საბუთების ნუსხა, ასეთის არსებობის შემთხვევაში.
ადმინისტრაციული საჩივარი წარდგენილი უნდა იქნას ადმინისტრაციული აქტის გამოქვეყნების, ან ოფიციალური წესით მისი გაცნობის დღიდან ერთ თვეში.
იგივე წესით გასაჩივრდება, ლიცენზიის/ნებართვის გამცემი ორგანოს მიერ კანონმდებლობით დადგენილი მოთხოვნების შეუსრულებლობა.
სამინისტრო არ განიხილავს საჩივარს, თუ:
ა) არსებობს სასამართლოს გადაწყვეტილება მოცემულ საქმესთან დაკავშირებით;
ბ) სასამართლოში იხილება დავა იმავე მხარეებს შორის, იგივე საკითხზე;
გ) არსებობს ამ ორგანოს გადაწყვეტილება იმავე საკითხზე;
დ) საჩივარი შეიტანა ქმედუუნარო პირმა;
ე) საჩივარი შეიტანა არაუფლებამოსილმა პირმა;
ვ) გასულია ადმინისტრაციული საჩივრის წარდგენის კანონით დადგენილი ერთთვიანი ვადა.
სამინისტრო საჩივრის განხილვის (წარმოებაში მიღების) შესახებ გადაწყვეტილებას იღებს წარდგენიდან 5 დღეში1. მანამდე კი, საჩივრის წარმდგენ პირს აძლევს საკუთარი მოსაზრების წარდგენის უფლებას.
სამინისტრო საჩივარს განიხილავს და გადაწყვეტილებას იღებს ერთი თვის ვადაში. იმ შემთხვევაში, თუ საქმისათვის არსებითი მნიშვნელობის მქონე გარემოების დადგენისათვის აუცილებელია ერთ თვეზე მეტი, მაშინ სამინისტრო უფლებამოსილია, საჩივრის მიღებიდან არა უგვიანეს 7 დღისა გამოიტანოს დასაბუთებული გადაწყვეტილება საჩივრის განხილვის ვადის ერთი თვით გაგრძელების შესახებ, რაც დაუყოვნებლივ ეცნობება მომჩივანს2.
სამინისტროს საჩივრის განხილვის შედეგად გამოაქვს ერთ-ერთი შემდეგი გადაწყვეტილება:
საჩივრის დაკმაყოფილების შესახებ;
საჩივრის დაკმაყოფილებაზე უარის თქმის შესახებ;
საჩივრის ნაწილობრივ დაკმაყოფილების შესახებ.
სამინისტროს გადაწყვეტილება შეიძლება გასაჩივრდეს თბილისის საოლქო სასამართლოში.
სასამართლოში გასაჩივრება
სარჩელი სასამართლოს უნდა წარედგინოს ადმინისტრაციული აქტის ან ადმინისტრაციულ საჩივართან დაკავშირებული გადაწყვეტილების გაცნობიდან 6 თვის ვადაში3.
სარჩელში უნდა აღინიშნოს:
1. სასამართლოს დასახელება, რომელშიც შედის სარჩელი;
2. მოსარჩელის ვინაობა და მისამართი;
3. მოპასუხე ადმინისტრაციული ორგანოს დასახელება და მისამართი, რომლის აქტიც საჩივრდება;
4. მოსარჩელის მოთხოვნა;
5. გარემოებები, რომლებსაც ემყარება მოსარჩელის მოთხოვნა;
6. მტკიცებულებები, რომლებიც ადასტურებენ ამ გარემოებებს;
7. სარჩელზე დართული საბუთების ნუსხა.
ლიცენზიის/ნებართვის თაობაზე გადაწყვეტილების გასაჩივრება არ იწვევს მისი მოქმედების შეჩერებას, თუ სამინისტრო ან სასამართლო არ მიიღებს სხვა გადაწყვეტილებას.
_______________
1. ზოგადი ადმინისტრაციული კოდექსი, 182-ე მუხლი, მე-2 ნაწილი;
2. ზოგადი ადმინისტრაციული კოდექსი, 183-ე მუხლი, მე-3 ნაწილი;
3. ადმინისტრაციული საპროცესო კოდექსი , 22-ე მუხლი, მე-3 ნაწილი.
 |
6 სალიცენზიო-სანებართვო რეესტრი |
▲back to top |
სალიცენზიო/სანებართვო რეესტრის სახეებია:
1. უწყებრივი რეესტრი, რომელსაც აწარმოებს საქართველოს შრომის, ჯანმრთელობისა და სოციალური დაცვის სამინისტრო;
2. სახელმწიფო რეესტრი, რომელსაც აწარმოებს საქართველოს იუსტიციის სამინისტრო.
საქართველოს შრომის, ჯანმრთელობისა და სოციალური დაცვის სამინისტრო ვალდებულია „საქართველოს საკანონმდებლო მაცნეში“ გამოაქვეყნოს მონაცემები ლიცენზიის გაცემის, მასში ცვლილებების შეტანის, მისი შეჩერების ანდა გაუქმების შესახებ, გადაწყვეტილების მიღებიდან 10 დღის ვადაში.
ლიცენზიის შესახებ მონაცემები სახელმწიფო და უწყებრივ სალიცენზიო/სანებართვო რეესტრში შეიტანება სარეგისტრაციო ჩანაწერის სახით.
ნებართვის შესახებ მონაცემები შეიტანება მხოლოდ უწყებრივ სალიცენზიო/სანებართვო რეესტრში.
ყველას აქვს უფლება, გაეცნოს სალიცენზიო/სანებართვო რეესტრის მონაცემებს და მიიღოს ლიცენზიებთან/ნებართვებთან დაკავშირებული საჯარო ინფორმაცია.
ინფორმაციის მისაღებად პირი შესაბამის უწყებაში წარადგენს წერილობით განცხადებას. სავალდებულო არ არის განცხადებაში მიეთითოს ინფორმაციის მოთხოვნის მოტივი და მიზანი.
აკრძალულია დაწესდეს რაიმე საფასური ინფორმაციის გაცემისათვის, ასლის გადაღებისათვის აუცილებელი საფასურის გარდა.
რეესტრის სამსახური მოთხოვნილ ინფორმაციას (მონაცემებს) გასცემს დაუყოვნებლივ. გაცემის ვადა შეიძლება გაიზარდოს 10 დღემდე, თუ საჯარო ინფორმაციის მოთხოვნაზე პასუხის გაცემა მოითხოვს:
1. სხვა დასახლებულ პუნქტში არსებული მისი სტრუქტურული ქვედანაყოფიდან ან სხვა საჯარო დაწესებულებიდან ინფორმაციის მოძიებას, დამუშავებას ანდა კონსულტაციას;
2. მნიშვნელოვანი მოცულობის, ერთმანეთთან დაუკავშირებელი ცალკეული დოკუმენტების მოძიებასა და დამუშავებას;
თუ ინფორმაციის გაცემისათვის საჭიროა 10-დღიანი ვადა, ადმინისტრაციული ორგანო ვალდებულია მოთხოვნისთანავე აცნობოს ამის შესახებ განმცხადებელს, შესაბამისი დასაბუთებით.
 |
7 ლიცენზიის/ნებართვის მფლობელი საწარმოების რეორგანიზაცია |
▲back to top |
ლიცენზიის (სალიცენზიო მოწმობის) გადაცემასთან დაკავშირებით ყურადება უნდა გავამახვილოთ საწარმოს რეორგანიზაციისა და ლიკვიდაციის მომენტებზე, განსაკუთრებით კი, რეორგანიზაციის სახეებზე და ლიცენზიების ბედზე აღნიშნულ შემთხვევებში.
ლიკვიდაციის შემთხვევაში საწარმო უქმდება და ბუნებრივია, მასზე გაცემული ლიცენზია ანდა ნებართვა ავტომატურად ძალდაკარგულია. თუმცა, უნდა აღინიშნოს, რომ ლიკვიდაცია არ არის ერთჯერადი აქტი და არ უნდა წარმოვიდგინოთ, რომ ამ დროს საწარმო მხოლოდ ამოიშლება რეესტრიდან. საწარმოს ლიკვიდაცია - ესაა პროცესი, სადაც ინიშნება ლიკვიდატორი, დგინდება კრედიტორების მოთხოვნები, დებიტორები, საწარმო ჩვეულებრივ განაგრძობს ფუნქციონირებას და მიმდინარე საქმეების დასრულების, ყველა მოთხოვნის დადგენისა და ვალდებულების გასტუმრების შემდეგ მარეგისტრირებელი უწყება ამოშლის მას რეესტრიდან. ლიკვიდაცია შეიძლება რამდენიმე წელიც გაგრძელდეს;
რეორგანოიზაცია მოიცავს რამდენიმე სახეს, რომელთაც დამოუკიდებელი სამართლებრივი მნიშვნელობა ენიჭება:
შეერთება (შერწყმა) - ორი ან მეტი დამოუკიდებელი საწარმო ერთიანდება ერთ საწარმოდ. ასეთ შემთხვევაში წინამორბედი 2 საწარმოს მიერ აღებული ლიცეზიები გადაეცემა უფლებამონაცვლეს და იგი არ საჭიროებს ახალი ლიცენზიის აღებას, თუმცა საწარმოების რეგისტრაციის შეერთების შედეგად წარმოქმნილი ახალი საწარმოს რეგისტრაციიდან 7 დღის ვადაში უნდა აცნობოს ლიცენზიის გამცემ ორგანოს, რათა მოახდინოს რეესტრული მონაცემების ცვლილება;
მიერთება - არსებობს რამდენიმე დამოუკიდებელი საწარმო, რომლებიც უერთდებიან ერთ საწარმოს. ასეთ შემთხვევაშიც საწარმო არ საჭიროებს ლიცენზირებას და საჭიროა მხოლოდ ზემოაღნიშნული წესით რეესტრული მონაცემების ცვლილება;
გაყოფა - ერთი საწარმო იყოფა ორ ან მეტ დამოუკიდებელ საწარმოდ. ასეთ შემთხვევაში გაყოფამდე აღებული ლიცენზია გადაეცემა ერთ-ერთს, ხოლო თუ დანარჩენ საწარმოებსაც სურთ ლიცენზირებადი საქმიანობის დაწყება, კანონით დადგენილი წესით უნდა მიიღონ ლიცენზია. იმ საწრმოს კი, რომელსაც გადაეცა გაყოფამდე მიღებული ლიცენზია, ეკისრება ვალდებულება მიმართოს ლიცენზიის გამცემ ორგანოს რეესტრული მონაცემების ცვლილებების განსახორციელებლად;
გამოყოფა - არსებობს ერთი საწარმო და მას გამოეყოფა ერთი ან რამდენიმე საწარმო. საწარმო კვლავ განაგრძობს ფუნქციონირებას, მას რჩება ლიცენზია და არ წარმოეშობა რეესტრული ცვლილებების თაობაზე ლიცენზიის გამცემისათვის მიმართვის ვალდებულება. გამოყოფილმა საწარმოებმა უნდა მიმართონ ლიცენზიის გამცემს კანონით დადგენილი წესით ლიცენზიის მისაღებად, თუ ისინი აპირებენ ლიცენზირებადი საქმიანობის დაწყებას;
გარდაქმნა - არსებობს ერთი ორგანიზაციულ-სამართლებრივი ფორმის საწარმო (მაგ. სააქციო საზოგადოება) და იგი გარდაიქმნება სხვა ორგანიზაციულ-სამართლებრივი ფორმის საწარმოდ (მაგ. შპს-დ). ასეთ შემთხვევაში ლიცენზიის ხელახლა აღება საჭირო არ არის და საჭიროა მხოლოდ რეესტრული მონაცემების ცვლილება.
 |
8 კონტროლის სისტემა |
▲back to top |
სამეწარმეო საქმიანობის კონსტიტუციურ პრინციპს წარმოადგენს მისი დამოუკიდებლობა და იგი შეიძლება შეიზღუდოს მხოლოდ კანონის საფუძველზე. არავის არა აქვს უფლება თვითნებურად შევიდეს საწარმოში და განახორციელოს მისი შემოწმება. ძირითადად ამ მიზნით, რომ თვითნებურად არავინ შესულიყო საწარმოში და განეხორციელებინა მისი შემოწმება, მიღებული იქნა „სამეწარმეო საქმიანობის კონტროლის შესახებ“ კანონი, რომელმაც საქართველოში კონტროლის სისტემა მოაქცია განსაზღვრულ ფარგლებში და მეწარმეთათვის შექმნა მყარი გარანტია მათი სამეწარმეო საქმიანობის უფლების დაცვის თვალსაზრისით. აღნიშნული კანონით საქართველოში კონტროლის სისტემის სტაბილიზაციის მიზნით შეიქმნა მაკონტროლებელ ორგანოთა სახელმწიფო რეესტრი. მაკონტროლებელ ორგანოთა სახელმწიფო რეესტრის მიზანია მაკონტროლებელ ორგანოთა აღრიცხვა და არაუფლებამოსილი ორგანოების მიერ სამეწარმეო საქმიანობის კონტროლის დაუშვებლობა.
იმისათვის, რომ მაკონტროლებელმა ორგანომ განახორციელოს კონტროლი მეწარმის საქმიანობაზე, იგი რეგისტრირებული უნდა იყოს მაკონტროლებელ ორგანოთა სახელმწიფო რეესტრში. მაკონტროლებელ ორგანოთა სახელმწიფო რეესტრს აწარმოებს საქართველოს იუსტიციის სამინისტრო. აკრძალულია სამეწარმეო საქმიანობაზე კონტროლი განახორციელოს იმ ორგანომ, რომელიც არ არის რეგისტრირებული მაკონტროლებელ ორგანოთა სახელმწიფო რეესტრში. სახელმწიფო, ადგილობრივი თვითმმართველობისა და მმართველობის ორგანომ, აგრეთვე შესაბამისმა ადმინისტრაციულმა ორგანომ მაკონტროლებელ ორგანოთა სახელმწიფო რეესტრში რეგისტრაციისათვის განცხადებით უნდა მიმართოს საქართველოს იუსტიციის სამინისტროს. განცხადებას უნდა დაერთოს: სამეწარმეო საქმიანობის სახეების ჩამონათვალი, რომლებზეც უნდა განახორციელოს კონტროლი; მითითება ნორმატიული აქტის (მაგ., კანონის) კონკრეტულ მუხლზე ან მუხლებზე, რომლებიც მას ანიჭებენ სამეწარმეო საქმიანობაზე კონტროლის განხორციელებას.
ლიცენზიის/ნებართვის გამცემ ორგანოებს ლიცენზიის ანდა ნებართვის მფლობელის საქმიანობის კონტროლის უფლება მიანიჭა „სამეწარმეო საქმიანობის ლიცენზიისა და ნებართვის გაცემის საფუძვლების შესახებ“ კანონის მე-7 მუხლის პირველი პუნქტის „ვ“ ქვეპუნქტითა და მე-20 მუხლის პირველი პუნქტის „ვ“ ქვეპუნქტით.
საქართველოს იუსტიციის სამინისტრო წარმოდგენილ განცხადებასა და თანდართულ მასალებს იხილავს მათი წარდგენიდან 10 დღის ვადაში და იღებს გადაწყვეტილებას მაკონტროლებელ ორგანოდ რეგისტრაციის ან რეგისტრაციაზე უარის თქმის შესახებ. თუ საქართველოს იუსტიციის სამინისტრომ ორგანო გაატარა რეგისტრაციაში როგორც მაკონტროლებელი, მაშინ იგი მასზე გასცემს რეგისტრაციის ცნობას.
კონტროლის შესახებ კანონმდებლობის მიხედვით კონტროლს არ წარმოადგენს კანონმდებლობით გათვალისწინებული ლიცენზიის, ნებართვის, სერტიფიკატის გაცემა, სავაჭრო ქსელში სერტიფიკატის მოთხოვნა და შესაბამისი აქტის შედგენა. მეწარმის შემოწმება ლიცენზიის ანდა ნებართვის მიღების შემდეგ ექცევა კონტროლის საერთო რეჟიმში და მაკონტროლებელ ორგანოს უფლება არა აქვს სასამართლო ბრძანების გარეშე განახორციელოს მისი კონტროლი.
ლიცენზიის/ნებართვის გამცემ ორგანოებს უფლება აქვთ განახორციელონ მეწარმის საქმიანობაზე კონტროლი მხოლოდ სალიცენზიო ანდა სანებართვო პირობებთან დაკავშირებით; კერძოდ, იმ წესების, ნორმებისა და მოთხოვნების ერთობლიობის შესრულებაზე კონტროლი, რომელთა დაცვაც მოეთხოვება ლიცენზიის/ნებართვის მფლობელს ლიცენზიით/ნებართვით განსაზღვრული საქმიანობის განხორციელებისას. ლიცენზიის ანდა ნებართვის მისაღებად დადგენილი პირობების შემოწმება, როგორც ზემოთ აღვნიშნეთ, კონტროლად არ ითვლება.
შემოწმების დაწყებამდე ლიცენზიის/ნებართვის გამცემი, როგორც მაკონტროლებელი ორგანო ვალდებულია შემოწმების დაწყებამდე მიმართოს იმ რაიონულ (საქალაქო) სასამართლოს, რომლის სამოქმედო ტერიტორიაზე გააჩნია მეწარმეს ადგილსამყოფელი (იურიდიული მისამართი). შუამდგომლობა მეწარმის შემოწმების თაობაზე უნდა შეიცავდეს საკმარის საფუძველს ბრძანების გასაცემად. შუამდგომლობაში მიეთითება შესამოწმებელი მეწარმის ზუსტი მონაცემები - სახელწოდება, ორგანიზაციულ-სამართლებრივი ფორმა, იურიდიული მისამართი - შემოწმების ვადა და ფარგლები ანუ მითითება იმის შესახებ თუ კონკრეტულად მეწარმის საქმიანობის თუ დოკუმენტაციის რა ნაწილი უნდა შეამოწმოს მაკონტროლებელმა ორგანომ. შუამდგომლობას ასევე უნდა დაერთოს მაკონტროლებელი ორგანოს სახელმწიფო რეესტრში რეგისტრაციის ცნობის ასლი, რომელსაც შესაბამისი უწყების მაკონტროლებელ ორგანოდ რეგისტრაციაში გატარებისას გასცემს საქართველოს იუსტიციის სამინისტრო. თუ ეს ცნობა არ დაერთო შუამდგომლობას, სასამართლო გამოიტანს განჩინებას ხარვეზის შესახებ და წარმოებაში არ მიიღებს შუამდგომლობას.
გამონაკლის შემთხვევაში, როცა შესაძლებელია საფრთხე შეექმნას სახელმწიფო უშიშროებას, ადამიანის სიცოცხლეს ან ჯანმრთელობას ანდა მტკიცებულებებს, მაკონტროლებელ ორგანოს უფლება აქვს სასამართლოსადმი მიმართვის გარეშე შეაჩეროს მეწარმის საქმიანობა შემოწმების საგნის ნაწილში და ამის შემდეგ დაუყოვნებლივ (იმავე დღეს ან თუ ეს ვერ ხერხდება არაუგვიანეს მომდევნო დღისა) მიმართოს მოსამართლეს შემოწმების შესახებ ბრძანების მისაღებად. თუ საწარმოს საქმიანობის შეჩერება შეუძლებელია ან იგი მნიშვნელოვან ზიანს მიაყენებს მეწარმეს ანდა შეჩერების წინააღმდეგია მეწარმე, მაკონტროლებელი ორგანო უფლებამოსილია დაიწყოს მეწარმის შემოწმება და 24 საათის განმავლობაში მიმართოს მოსამართლეს შუამდგომლობით დაწყებული შემოწმების კანონიერად ცნობისა და შემოწმების შესახებ ბრძანების გაცემის თხოვნით. ასეთ შემთხვევაში მაკონტროლებელი ორგანო ვალდებულია სასამართლოსადმი გაგზავნილ შუამდგომლობაში დაასაბუთოს თუ რაში მდგომარეობდა შემოწმების გადაუდებელი აუცილებლობა, რამაც განაპირობა შემოწმების დაწყება მოსამართლის ბრძანების მიღებამდე.
მოსამართლე შუამდგომლობას განიხილავს მაკონტროლებელი ორგანოსა და მეწარმის თანდასწრებით და იღებს გადაწყვეტილებას შუამდგომლობის წარდგენიდან 24 საათის განმავლობაში. შუამდგომლობის განხილვისას მეწარმეს ანდა მის წარმომადგენელს ეძლევა შესაძლებლობა მისცეს განმარტებები და ჩამოაყალიბოს საწინააღმდეგო მოსაზრებები. მოსამართლე ბრძანებას მეწარმის საქმიანობის შემოწმების შესახებ გასცემს მხოლოდ იმ შემთხვევაში, თუ მაკონტროლებელი ორგანო მას წარუდგენს შესაბამის ინფორმაციას დასაბუთებული და საფუძვლიანი ეჭვით მეწარმის მიერ კანონმდებლობის მოთხოვნათა დარღვევის შესახებ. თუ არ არსებობს მეწარმის საქმიანობის ფორმალური და ფაქტობრივი საფუძვლები, მოსამართლეს გამოაქვს დადგენილება მეწარმის შემოწმებაზე უარის თქმის შესახებ. თუ მეწარმის საქმიანობის შემოწმება სასამართლოსადმი მიმართვამდე დაწყებული იყო და მოსამართლე გამოიტანს დადგენილებას მეწარმის შემოწმებაზე უარის თქმის შესახებ, მაშინ მეწარმის შემოწმება დაუყოვნებლივ უნდა შეწყდეს. ასეთ შემთხვევაში მეწარმეს უფლება აქვს მოსთხოვოს მაკონტროლებელ ორგანოს შემოწმებით მიყენებული ზიანის ანაზღაურება.
მოსამართლის მიერ შუამდგომლობის დაკმაყოფილება და მეწარმის საქმიანობის შემოწმების შესახებ ბრძანების მიღება არ არის მაკონტროლებელი ორგანოს მიერ კონტროლის ავტომატურად დაწყების საფუძველი; ამისათვის საჭიროა მოსამართლის მიერ მიღებული ბრძანება შევიდეს კანონიერ ძალაში ანუ უნდა გავიდეს ბრძანების გასაჩივრების ვადა. ბრძანების გასაჩივრება აჩერებს მის ძალაში შესვლას. მოსამართლის ბრძანება შეიძლება გასაჩივრდეს მხარის მიერ შესაბამის საოლქო სასამართლოში ბრძანების ასლის მიღებიდან 24 საათის განმავლობაში. საოლქო სასამართლო საქმეს განიხილავს საჩივრის შეტანიდან 3 დღის განმავლობაში. საოლქო სასამართლოს მიერ მიღებული გადაწყვეტილება საბოლოოა და იგი არ გასაჩივრდება უზენაეს სასამართლოში.
თუ მოსამართლის მიერ მიღებულია დადგენილება მეწარმის შემოწმებაზე უარის თქმის შესახ, მაშინ მაკონტროლებელ ორგანოს იგივე ვადაში და წესით შუძლია ეს დადგენილება გაასაჩივროს საოლქო სასამართლოში. ასეთ შემთხვევაში დაწყებული შემოწმება შეჩერდება და მისი შემდგომი გაგრძელების ან შეწყვეტის ბედი დამოკიდებული იქნება საოლქო სასამართლოს მიერ შესაბამისი გადაწყვეტილების მიღებამდე.
კონროლის სიტემის სრულყოფის, გამოვლენილი ნაკლოვანებების თავიდან აცილებისა და სახელმწიფოში მეწარმეებზე განხორციელებული კონტროლის თაობაზე ერთიანი სტატისტიკური მონაცემების უზრუნველყოფის მიზნით თითოეული მაკონტროლებელი ორგანო ვალდებულია ყოველი წლის 25 იანვრამდე წარუდგინოს საქართველოს პრეზიდენტს და საქართველოს პარლამენტს ანგარიში გასული წლის განმავლობაში ბრძანების გაცემის შესახებ სასამართლოში წარდგენილი შუამდგომლობების, სასამართლოს მიერ გაცემული ბრძანებების რაოდენობისა და მოსამართლის ბრძანების საფუძველზე განხორციელებული შემოწმების შედეგების შესახებ.
 |
9 პასუხისმგებლობა |
▲back to top |
ლიცენზიის ანდა ნებართვის გარეშე სამეწარმეო საქმიანობისათვის დარღვევის ხასიათისა და ხარისხის შესაბამისად დაწესებულია ადმინისტრაციული და სისხლისსამართლებრივი პასუხისმგებლობა. ადმინისტრაციული პასუხისმგებლობის დაკისრებისათვის საკმარისია მხოლოდ ლიცენზიის ან ნებართვის გარეშე საქმიანობის ფაქტი, მაშინ როდესაც სისხლისსამართლებრივი პასუხისმგებლობისათვის მხოლოდ საქმიანობის ფაქტი არ არის საკმარისი; დამატებით აუცილებელია ლიცენზიის ან ნებართვის გარეშე საქმიანობის შედეგად მნიშვნელოვანი ზიანი იქნეს გამოწვეული, რაც თავის მხრივ შეფასებასა და მტკიცებას მოითხოვს ან სახეზე უნდა იყოს მეწარმის მიერ დიდი ოდენობით შემოსავლის მიღება.
სისხლისსამართლებრივი პასუხისმგებლობა დაწესებულია ლიცენზიის/ნებართვის გამცემი ორგანოების მოხელეების საქმიანობაზეც, თუ ისინი დაუსაბუთებლად უარს ეტყვიან ლიცენზიის/ნებართვის მაძიებელს ან მისი გაცემის შემდეგ განახორციელებენ სალიცენზიო/სანებართვო პირობების შემოწმებას კონტროლის მომწესრიგებელი კანონმდებლობის დარღვევით, რაც მეწარმისათვის მნიშვნელოვან ზიანს გამოიწვევს.
ადმინისტრაციული პასუხისმგებლობა
სამეწარმეო საქმიანობის წესის დარღვევა
1. სამედიცინო, საექიმო ან ფარმაცევტული საქმიანობა სახელმწიფო ნებართვის
(ლიცენზიის, სერტიფიკატის) გარეშე -
გამოიწვევს დაჯარიმებას ათასი ლარის ოდენობით.
2. იგივე ქმედების ჩადენა განმეორებით -
გამოიწვევს დაჯარიმებას ორი ათასი ლარის ოდენობით.
(ადმინისტრაციულ სამართალდარღვევათა კოდექსის 442 მუხლის პირველი და მესამე ნაწილი
სიხსლისსამართლებრივი პასუხისმგებლობა
უკანონო სამეწარმეო საქმიანობა
1. სამეწარმეო საქმიანობა რეგისტრაციის ან სპეციალური ნებართვის/ლიცენზიის გარეშე ანდა ლიცენზირების პირობის დარღვევით, რამაც მნიშვნელოვანი ზიანი გამოიწვია ან რასაც თან ახლდა დიდი ოდენობით შემოსავლის მიღება -
ისჯება ჯარიმით ან ტუსაღობით ვადით ოთხ თვემდე ანდა თავისუფლების აღკვეთით ვადით ორ წლამდე.
2. იგივე ქმედება, ჩადენილი:
ა) ჯგუფურად;
ბ) არაერთგზის;
გ) ასეთი დანაშაულისათვის მსჯავრდებულის მიერ _
ისჯება ჯარიმით ან თავისუფლების აღკვეთით ვადით ხუთ წლამდე.
/სისხლის სამართლის კოდექსი, მუხლი 192/
კანონიერი სამეწარმეო საქმიანობისათვის ხელის შეშლა
დაუსაბუთებლად უარის თქმა საწარმოს რეგისტრაციაზე ან სპეციალური ნებართვის (ლიცენზიის) გაცემაზე, ანდა მისი ეკონომიკური საქმიანობის უფლების ან თავისუფლების შეზღუდვა, საწარმოს საქმიანობაზე კონტროლის კანონმდებლობის დარღვევით განხორციელება, აგრეთვე მის საქმიანობაში ჩარევა, რამაც მნიშვნელოვანი ზიანი გამოიწვია -
ისჯება ჯარიმით ან საზოგადოებისათვის სასარგებლო შრომით ვადით ასოციდან ას ოთხმოც საათამდე ანდა ტუსაღობით ვადით სამ თვემდე, თანამდებობის დაკავების ან საქმიანობის უფლების ჩამორთმევით ვადით სამ წლამდე.
/სისხლის სამართლის კოდექსი, მუხლი 190/
 |
10 ობიექტის ჰიგიენური სერტიფიკატი |
▲back to top |
ნებართვის მისაღებად ერთ-ერთი პირობა არის ობიექტის ჰიგიენური სერტიფიკატი, რომელიც სავალდებულოა ობიექტის ექსპლუატაციისათვის და ადასტურებს ობიექტის სანიტარიულ ნორმებთან შესაბამისობას. სერტიფიკატის მისაღებად თავის მხრივ დადგენილია საკმაოდ მოცულობითი და გაურკვეველი მოთხოვნები, რითაც იგი თვისობრივად ემსგავსება ნებართვას.
მოთხოვნები ობიექტის ჰიგიენურ სერტიფიკატზე დადგენილია სანიტარიული კოდექსით. კერძოდ:
განცხადება;
ეპიდემიური თვალსაზრისით მნიშვნელოვანი ობიექტის სანიტარიული მინიმუმის ჩაბარებას დაქვემდებარებულ მუშაკთა ჩამონათვალი;
შრომის, ჯანმრთელობისა და სოციალური დაცვის სამინისტროს ჯერ არ დაუდგენია, თუ რა ტიპის საწარმოა ეპიდემიური თვალსაზრისით მნიშვნელოვანი ობიექტი, აგრეთვე სანიტარიული მინიმუმის ჩაბარებას დაქვემდებარებული მუშაკების ჩამონათვალი და ბოლოს მათი სანიტარიული მინიმუმის ჩაბარების წესი.
ობიექტის პროექტი (საჭიროების შემთხვევაში);
ტექნოლოგიური პროცესის (მომსახურების) ნორმატიული და ტექნიკური დოკუმენტაცია;
პროდუქციაზე ეროვნული ან მეწარმე სუბიექტის სტანდარტი;
ობიექტზე გამოყენებული ადამიანის ჯანმრთელობისათვის პოტენციურად საშიში მასალის, ნივთიერების, ნაკეთობის, მოწყობილობის, დანადგარის, ხელსაწყოებისა და სამუშაო ინსტრუმენტების უსაფრთხოების დამადასტურებელი დოკუმენტები (ჰიგიენური სერტიფიკატი, ჰიგიენური დასკვნა და სხვა), რომლებიც გაცემულია პროდუქციის დამამზადებელი ქვეყნის უფლებამოსილი ორგანოს მიერ.
ობიექტის ჰიგიენური სერტიფიკატის გაცემის პროცედურით გათვალისწინებულია ობიექტის ჰიგიენური შეფასება (საჭიროების შემთხვევაში ლაბორატორიული გამოცდის, კვლევის მეთოდების გამოყენება) და წარმოდგენილი დოკუმენტაციის განხილვა.
გაურკვეველია, რას ნიშნავს საჭიროების შემთხვევაში, რადგანაც მიკრობებისა და ბაქტერიების აღმოჩენა შესაძლებელია, მხოლოდ ლაბორატორიული გამოცდის საშუალებით. ჩვენი აზრით, კანონში არ უნდა ხვდებოდეს ჩანაწერები, რომლებიც რეალურად ქმნიან სუბიექტური გადაწყვეტილებების მიღების შესაძლებლობას.
ობიექტის ჰიგიენური სერტიფიკატი გაიცემა (ან გაცემაზე უარი ითქმება) მისი მფლობელის (მესაკუთრის) მიერ სანიტარიული სამსახურის დაწესებულებაში განცხადების წარდგენიდან 15 დღეში, ხოლო თუ ობიექტის შესწავლა საჭიროებს ლაბორატორიული გამოცდის, კვლევის მეთოდების გამოყენებას - 30 დღეში.
ობიექტის ჰიგიენური სერტიფიკატის გაცემაზე უარის თქმის შემთხვევაში სანიტარიული სამსახურის დაწესებულება ვალდებულია ობიექტის მფლობელს (მესაკუთრეს) წერილობით აცნობოს:
სანიტარიული ნორმებითა და სხვა ნორმატიული დოკუმენტებით გათვალისწინებული მოთხოვნები, რომლებსაც არ აკმაყოფილებს ობიექტი;
სანიტარიულ-ტექნიკურ, პროფილაქტიკურ სანიტარიულ-ჰიგიენურ და სანიტარიულ-ეპიდსაწინააღმდეგო ღონისძიებათა ჩამონათვალი, რომელთა შესრულების შემდეგ შესაძლებელია განმეორებით დადგეს ობიექტის ჰიგიენური სერტიფიკატის გაცემის საკითხი.
ობიექტის ჰიგიენური სერტიფიკატი განმეორებით გაიცემა, თუ:
შეიცვალა ჰიგიენური სერტიფიკატით ობიექტისათვის დადგენილი საქმიანობის პროფილი და სიმძლავრე, პროდუქციის ასორტიმენტი და რაოდენობა (მოცულობა);
განხორციელდა ობიექტის რეკონსტრუქცია (ტექნიკური და ტექნოლოგიური განახლება);
ობიექტის ჰიგიენური სერტიფიკატის გაუქმების შემდეგ შესრულდა სანიტარიული სამსახურის დაწესებულების მიერ დასახული სანიტარიულ-ტექნიკური, პროფილაქტიკური სანიტარიულ-ჰიგიენური და სანიტარიულ-ეპიდსაწინააღმდეგო ღონისძიებები.
როგორც უკვე აღვნიშნეთ სანიტარიული კოდექსის 39-ე მუხლი, რომელიც შეეხება ობიექტის ჰიგიენურ სერტიფიკატს (გაცემის წესი, მისი შეჩერება და განახლება) გაუგებარი და სანიტარიული ზედამხედველობის სამსახურის მაღალი თანამდებობის პირებისათვის განუსაზღვრელი, სუბიექტურად გამოსაყენებელი უფლებამოსილების მიმნიჭებელია, რაც საბოლოოდ არასასურველი შედეგის მომტანია სანიტარიულ-ჰიგიენური მდგომარეობის დაცვის სისტემაში.
____________________
შენიშვნა: ობიექტის ჰიგიენური სერტიფიკატის გასაცემად კანონით მოსაკრებლის დაწესებამდე დროებით გაიცემა ჰიგიენური დასკვნა, რომლის გასაცემად ოფიციალურად (კანონით) მოსაკრებელი არ არის დაწესებული და სანიტარიული ზედამხედველობის ინსპექციამ იგი უნდა გასცეს უფასოდ. სერტიფიკატის ნაცვლად დასკვნის გაცემა შეთანხმებულია ნებართვის გამცემ ორგანოსთან და მეწარმეებს მასთან დაკავშირებით პრობლემა არ წარმოშობიათ.
 |
11 დასკვნები და რეკომენდაციები |
▲back to top |
წინამდებარე ნაშრომში წამოჭრილი პრობლემების გათვალისწინებით შევეცადეთ, შეგვემუშავებინა გარკვეული სახის რეკომენდაციები.
ჯანდაცვის სფეროში ლიცენზიის მისაღებად დადგენილი ერთ-ერთი სალიცენზიო პირობა სამედიცინო და ფარმაცევტული დაწესებულების პასპორტი - უდიდესი პრობლემაა. კანონში მიტითებულია, რომ „პასპორტები არის მინიმალური მოთხოვნების ერთობლიობა...“ თუმცა ხშირ შემთხვევაში პასპორტებში მოცემული ჩამონათვალი არაა მინიმალური და მისი დაკმაყოფილება საქართველოში დღეს არსებული მატრერიალურ-ტექნიკური ბაზით შეუძლია მხოლოდ რამდენიმე დაწესებულებას.
პასპორტი წინააღმდეგობაში მოდის „სამეწარმეო საქმიანობის ლიცენზიისა და ნებართვის გაცემის საფუძვლების შესახებ“ კანონთან, რომლის მიხედვითაც სალიცენზიო პირობა შეიძლება დადგინდეს მხოლოდ კანონით და არა კანონქვემდებარე აქტით. პასპორტების შემთხვევაში სახეზე გვაქვს მხოლოდ ფორმალური შესაბამისიბა, რადგან “სამედიცინო და ფარმაცევტული საქმიანობის ლიცენზირების შესახებ კანონში მითითებულია, რომ პასპორტები არის საქართველოს შრომის ჯანმრთელობისა და სოციალური დაცვის მინისტრის ბრძანებით დამტკიცებული მინიმალური მოთხოვნების ერთობრიობა, რასაც უბდა აკმაყოფილებდეს ლიცენზიის მაძიებელი. პასპორტის სალიცენზიო პირობად კანონში ჩაწერასა და შემდგომ მის ზემოაღნიშნულ განმარტებას მხოლოდ ის საფუძველი გააჩნია, რომ სმედიცინო და ფარმაცევტულ საქმიანობის ლიცენზირების კანონი თითქოს და შესაბამისობაში ყოფილიყო „სამეწამრეო საქმიანობის ლიცენზიისა დანებართვის შესახებ“ კანონის დებულებებთან. სახეზე გვაქვს ფორმალური შესაბამსობა, თუმცა, არა სამართლებრივი. რეალურად „პასპორტი“ დამტკიცებული კანონქვემდებარე აქტით.
პასპორტები, თავის მხრივ, მოითხოვს გადასინჯვას, თიმცა „პასპორტები” მოცულობის მხრივ საკმაოდ დიდი დოკუმენტია და მოიცავს შრომატევად საქმიანობას-უნდა შეიქმნას ჯანდაცვის დარგის სპეციალისტებით დაკომპლექტებული კომისია, რომელიც მოახდენს პასპორტების გადახალისებას საერთაშორისო მოთხოვნების გათვალისწინებით. რეალური პრობლემა, რომელიც აბრკოლებს პასპორტების გადასინჯვას, არის დაფინანსების არარსებობა, თუმცა აქვე უნდა აღინიშნოს, რომ არიან ცალკეული დაინტერესებული ორგანიზაციები, რომლებიც მზად არიან დააფინანსონ პასპორტების გადასინჯვა მისი ცალკეული სახეების მიხედვით. მიუხედავად იმისა, რომ პასპორტების ცალკეული სახეობის გადასინჯვას დააფინანსებენ დაინტერესებული ორგანიზაციები, შრომის, ჯანმრთელობისა და სოციალური დაცვის სამინისტრომ გადასინჯვა რამდენიმე წლით შეაყოვნა.
ასევე აღსანიშნავია, რომ ერთ-ერთ სალიცენზიო პირობად დაწესებულია განაცხადი ხარისხის გარე კონტროლის სისტემაში მონაწილეობის შესახებ. დასაწყისშივე უნდა აღინიშნოს, რომ განაცხადი ხარისხის გარე კონტროლის სისტემაში მონაწილეობის შესახებ გულისხმობს, ლიცენზიის მაძიებლის მზადყოფნას, სადაც იგი დაადასტურებს რომ მზადაა მონაწილეობა მიიღოს მასში. თავისთავად კონტროლის გარე სისტემა გულისხმობს გარკვეული ლაბორატორიების არსებობას, სადაც უნდა მოხდეს შემოწმება, რათა გამოვლინდეს შეუძლია თუ არა ლიცენზირებულ საწარმოს სხვა ობიექტის შემოწმება საერთაშორისო მოთხოვნების შესაბამისად; თუმცა ასეთი ლაბორატორიები საქართველოში ჯერ-ჯერობით არ არის ჩამოყალიბებული. ლიცენზიის გამცემ სამსახურს არ გააჩნია სრულყოფილი ინფორმაცია ხარისხის გარე კონტროლის შესახებ მისი შემოღება მოხდა ნაჩქარევად, მხოლოდ იმ საფუძველით, რომ „ამისი წინაპირობა არსებობდა“ გამოდის რომ ამ სალიცენზიო პირობას დააკმაყოფილებს ყოველი მაძიებელი, ვინც კი ლიცენზიის გამცემ ორგანოს მიაწოდებს წერილობით განცხადებას, რომლითაც იკისრებს ვალდებულებას, რომ ლიცენზიის ფლობის განმავლობაში მზადაა მიიღოს მონაწილეობა ხარისხის გარე კონტროლის სისტემაში;
ობიექტის ჰიგიენური სერტიფიკატი, რომელის აღება ცალკე პროცედურაა. მის მისაღებად დადგენილი პირობები რთული შესასრულებელია როგორც წვრილი, ასევე მსხვილი მეწარმეთათვის და პირდაპირ მიუთითებს კორუფციის შესაძლებლობებზე. აუცილებელია დაუყოვნებლივ სანიტარიულ კოდექსში ცვლილებების შეტანა, რაც ლიბერალურს გახდის ჰიგიენური სერტიფიკატის აღებას და შესაბამისად არსებული სისტემაც იქნება რეალურად ფუნქციონირებადი.
კვლევის პროცესში მეწარმეების მხრიდან აღნიშნული იყო ჯანდაცვის სისტემის გაუმჭირვალობა. მათი განცხადებით დროულად არ ქვეყნდება ცნობა საჯარო გაცნობისათვის და ასევე ხშირ შემთხვევაში ირღვევა ადმინისტრაციული წარმოების პროცესი. ერთ-ერთი მეწარმის განცხადებით, რომელმაც გასულ თვეში მიიღო ლიცენზია საერთოდ არ იცოდა ჩვენს მიერ გამოცემული გზამკვლევის არსებობა და არც სამინისტროს წარმომადგენლებს არ გადაუციათ (ჯანდაცვის სამინისტროს გადაეცა გზამკვლევის 700 ეგზემპლარი);
აგრეთვე კვლევის შედეგად აღმოცნდა, რომ ეკონომიკის სამინისტროს ფასების კონტროლის სახელმწიფო ინსპექციის წარმომადგენლები სრულიად უკანონოდ ახორციელებდნენ სამედიცინო და ფარმაცევტული დაწესებულებების საქმიანობის კონტროლს, კერძოდ ისინი მოითხოვდნენ სამედიცინო დაწესებულებებს (სამართლებრივი ფორმის მიუხედავად) გამოეკრათ მომხარებელთათვის თვალსაჩინო ადგილზე.
ასევე კვლევის შედეგად გამოვლინდა, რომ სასამართლო დადგენილება, რომლის საფუძველზეც მაკონტროლებელ ორგანოს შეეძლო ამა თუ იმ ორგანიზაციის შემოწმება, გაიცემოდა სასამართლო პროცესზე მფლობელის დასწრების გარეშე, რაც მათი აზრით უსამართლო იყო. „სამეწარმეო საქმიანობის კონტროლის შესახებ” კანონში მკაცრად არის მითითებული, რომ საწარმოს კონტროლი შეიძლება განახორციელოს მაკონტროლებელმა ორგანომ მხოლოდ სასამართლო დადგენილების საფუძველზე.
 |
12 რეზიუმე |
▲back to top |
წინამდებარე მოხსენებაში (მიმოხილვაში) განხილული საკითხები ლიცენზიისა და ნებართვის სფეროს მოწესრიგების ერთგვარ მცდელობას წარმოადგენდა. ბუნებრივია, რომ იგი ვერ იქნებოდა ამომწურავი და სრულყოფილი შესაბამისი დარგების სპეციფიკიდან, სახელმწიფო მართვის აპარატში დღეისათვის არსებული მდგომარეობიდან, საკანონმდებლო რეგულირების მექანიზმების მონიტორინგის გაუმართავი და დაუხვეწავი სისტემიდან გამომდინარე. თუმცა ამ სფეროში მომუშავე ექსპერტებს, მეწარმეებს, სახელმწიფო ორგანოების წარმომადგენლებს შეუქმნის გარკვეულ წარმოდგენას არსებული პრობლემატიკის შესახებ, რამაც რთული სიტუაციიდან მართებული გამოსავლის სწორი ხედვა უნდა ჩამოუყალიბოს ყველა დაინტერესებულ პირს. ბუნებრივია, ის სირთულეები, რომლებიც დღესაც მრავლადაა ლიცენზიისა და ნებართვის სისტემაში, საჭიროებს გადაუდებელ მოწესრიგებას, როგორც საკანონმდებლო ცვლილებების, ასევე კანონის მოთხოვნათა განუხრელი აღსრულების დონეებზე. ეს კი თავის მხრივ ჩვენი მხრიდან შემდგომი კვლევების, მონიტორინგის, სათანადო რეკომენდაციების შემუშავებისა და მათი აქტიური მხარდაჭერის საგანი უნდა გახდეს.
 |
13 დანართი |
▲back to top |
დანართი 1
რეგისტრირებულია
საქართველოს იუსტიციის სამინისტროში
რეგისტრაციის ნომერი 470.010.000.11.119.004.505
მიღებულია 2000 წლის 9 ნოემბერს - N 193/ნ;
ცვლილები 2002 წლის 2 აპრილს - N 85/ნ.
საქართველოს შრომის, ჯანმრთელობისა და სოციალური დაცვის
მინისტრის ბრძანება სამედიცინო და ფარმაცევტული პერსონალისათვის
სახელმწიფო სერტიფიკატის მინიჭების შესახებ
დებულება
სამედიცინო და ფარმაცევტული
პერსონალისთვის სახელმწიფო სერტიფიკატის
მინიჭების შესახებ
თავი I. ზოგადი ნაწილი
მუხლი 1. დებულება შემუშავებულია „ჯანმრთელობის დაცვის შესახებ“ საქართველოს კანონის საფუძველზე.
მუხლი 2. უმაღლესი და საშუალო სამედიცინო და ფარმაცევტული პერსონალისათვის სპეციალისტის სახელმწიფო სერტიფიკატის (შემდგომში სახელმწიფო სერტიფიკატი) მინიჭების მიზანია ქვეყნის მოსახლეობის ჯანმრთელობის დაცვა არაპროფესიული და არაკომპონენტური სამედიცინო და ფარმაცევტული პერსონალის საქმიანობისაგან.
მუხლი 3. სახელმწიფო სერტიფიკატი უმაღლესი და საშუალო სამედიცინო და ფარმაცევტული განათლების მქონე პირებს (სპეციალისტებს) ანიჭებს დამოუკიდებელი სამედიცინო ან ფარმაცევტული პროფესიული საქმიანობის უფლებას განსაზღვრულ სფეროში.
მუხლი 4. სერტიპიფიკატის მინიჭებით სახელმწიფო იძლევა გარანტიას, რომ მის მფლობელს აქვს უნარი აწარმოოს დამოუკიდებელი სამედიცინო ან ფარმაცევტული საქმიანობა საქართველოში მოქმედი პროფესიული სტანდარტების ფარგლებში.
მუხლი 5. სერტიფიკაცია არის სამედიცინო და ფარმაცევტული პერსონალის პროფესიული ცოდნისა და პრაქტიკული უნარ-ჩვევების დონის შეფასება (მედიცინისა და ფარმაციის გარკვეულ სპეციალობაში) სახელმწიფო სასერტიფიკაციო გამოცდებით. პირი, რომელსაც მინიჭებული აქვს სახელმწიფო სერტიფიკატი, გარკვეული პერიოდულობით ექვემდებარება რესერტიფიკაციას. სერტიფიკაცია და რესერტიფიკაცია სავალდებულოა მხოლოდ დამოუკიდებელი პროფესიული საქმიანობის მსურველთათვის.
მუხლი 6. დამოუკიდებელი სამედიცინო ან ფარმაცევტული საქმიანობის უფლება სპეციალისტს ენიჭება სახელმწიფო სასერტიფიკაციო გამოცდის ჩაბარებისა და პროფესიული საქმიანობის მიხედვით, მისი ფიზიკური და ფსიქიკური ჯანმრთელობის მდგომარეობის დამადასტურებელი დოკუმენტების წარმოდგენის საფუძველზე.
მუხლი 7. სახელმწიფო სერტიფიკატის მოქმედება ვრცელდება მხოლოდ საქართველოს ტერიტორიაზე.
მუხლი 8. საქართველოში სამედიცინო და ფარმაცევტული პერსონალის სერტიფიკაციის/რესერტიფიკაციის პროცესს ხელმძღვანელობს საქართველოს შრომის, ჯანმრთელობისა და სოციალური დაცვის სამინისტროსთან არსებული უმაღლესი და საშუალო სამედიცინო და ფარმაცევტული პერსონალისთვის სახელმწიფო სერტიფიკატის მიმნიჭებელი საბჭო (შემდგომში - „საბჭო“) შრომის, ჯანმრთელობისა და სოციალური დაცვის მინისტრის თავმჯდომარეობით, ხოლო წარმართავს სამინისტროს შესაბამისი სამსახური და დიპლომისშემდგომი განათლების სახელმწიფო სამედიცინო აკადემია, ექიმთა და დარგობრივ ასოციაციებთან თანამშრომლობით.
მუხლი 9. შინაარსს დოკუმენტისა, რომელსაც ეწოდება „სახელმწიფო სერტიფიკატი“, მისი აღრიცხვისა და შენახვის წესებს შეიმუშავებს საბჭო და ამტკიცებს საქართველოს შრომის, ჯანმრთელობისა და სოციალური დაცვის მინისტრი, ხოლო სახელმწიფო სერტიფიკატს გასცემს და რეესტრს აწარმოებს სამინისტროს შესაბამისი სამსახური.
მუხლი 10. სასერტიფიკაციო გამოცდა შეიძლება გადაუვადდეს იმ პირებს, რომლებიც შრომის კანონმდებლობის თანახმად დროებით გათავისუფლებულნი არიან სამუშაოს შესრულებისაგან.
მუხლი 11. ამჟამად მომუშავე სპეციალისტებისათვის სასერთიფიკაციო გამოცდების გრაფიკს და მათი ჩაბარების ვადებს ცალკეული სპეციალობების მიხედვით განსაზღვრავს სამინისტრო მოქმედი კანონმდებლობის შესაბამისად.
მუხლი 11.1 უმაღლესი განათლების სამედიცინო სპეციალობის პერსონალის სახელმწიფო სერტიფიკატი არის სამი სახის:
ა) ექიმის სახელმწიფო სერტიფიკატი;
ბ) ფარმაცევტის სახელმწიფო სერტიფიკატი;
გ) უმაღლესი არასამედიცინო განათლების სამედიცინო პერსონალის სახელმწიფო სერტიფიკატი;
თავი II.
ექიმის სახელმწიფო სერტიფიკატი
მუხლი 12. 1998 წლიდან ექიმის სახელმწიფო სერტიფიკატი სავალდებულოა იმ პირებისათვის*, რომლებიც იწყებენ საექიმო საქმიანობას ან იცვლიან სამუშაო ადგილს ან იკავებენ უფრო მაღალ საექიმო თანამდებობას.
მუხლი 13. სახელმწიფო სერტიფიკატი ენიჭება საქართველოს იმ მოქალაქეს, რომელსაც განათლება მიღებული აქვს სახელმწიფო აკრედიტაციის** და ლიცენზიის მქონე უმაღლეს სამედიცინო სასწავლებელში, ფაკულტეტზე ან სექტორზე, ჩაბარებული აქვს სახელმწიფო სასერტიფიკაციო გამოცდები და წარმოადგენს ამ დებულების მე-6 მუხლში აღნიშნულ დოკუმენტებს.
მუხლი 14. საექიმო საქმიანობის თავისებურებიდან გამომდინარე, ექიმის სახელმწიფო სერტიფიკატი შეიძლება იყოს შემდეგი სახის:
ა) „ზოგადი პროფილის ექიმის“ (ექიმი-მკურნალი; ექიმი-პედიატრი; ექიმისტომატოლოგი; ექიმი-პროფილაქტიკოსი; ჯანდაცვის მენეჯერი; ექიმი-ლაბორანტი; სამხედრო-ექიმი) - უფლებას აძლევს იმუშაოს პირველადი სამედიცინო დახმარების ქსელში
ბ) „ექიმი-სპეციალისტის“ - უფლებას აძლევს იმუშაოს სერტიფიკატით განსაზღვრულ მედიცინის სპეციალობაში.
მუხლი 15. დამოუკიდებელი საექიმო საქმიანობა ნებადართულია მხოლოდ სერტიფიკატით განსაზღვრულ სპეციალობაში. ორ ან მეტ სპეციალობაში სახელმწიფო სერტიფიკატის მქონე პირს საექიმო საქმიანობა შეუძლია აწარმოოს ერთდროულად სერტიფიკატებით განსაზღვრულ ყველა სპეციალობებში.
მუხლი 16. სახელმწიფო სერტიფიკატი გაიცემა საბჭოს გადაწყვეტილებით სასერტიფიკაციო გამოცდის (სამინისტროს მიერ დამტკიცებული პროგრამისა და შეფასების კრიტერიუმების მიხედვით ჩატარებული) შედეგების და წარმოდგენილი საბუთის განხილვის საფუძველზე.
მუხლი 17. საბჭოს გადაწყვეტილებით, გამონაკლისის სახით, სასერტიფიკაციო გამოცდის ჩაბარების გარეშე, სამედიცინო საქმიანობის სპეციალისტის სახელმწიფო სერტიფიკატი შეიძლება მიენიჭოს საქართველოს იმ მოქალაქეს, რომელსაც 1997 წლის 1 ნოემბრამდე მინიჭებული აქვს მედიცინის მეცნიერებათა დოქტორის სამეცნიერო ხარისხი და გააჩნია უკანასკნელი 10 წლის განმავლობაში შესაბამისი სპეციალობით მუშაობის არანაკლებ 5 წლის სტაჟი ან - მედიცინის მეცნიერებათა კანდიდატის სამეცნიერო ხარისხი და უკანასკნელი 15 წლის განმავლობაში აქვს შესაბამისი კლინიკური სპეციალობით მუშაობის არანაკლებ 10 წლის სტაჟი.
მუხლი 18. „ზოგადი პროფილის ექიმის“ სახელმწიფო სერტიფიკატის მისაღებად სახელმწიფო სასერტიფიკაციო გამოცდაზე დაიშვება სახელმწიფო აკრედიტაციის მქონე უმაღლესი სამედიცინო სასწავლებლების, ფაკულტეტების ან სექტორების კურსდამთავრებულები და ამჟამად მომუშავე ექიმ-სპეციალისტები.
მუხლი 19. „ექიმ-სპეციალისტის“ სახელმწიფო სერტიფიკატის მისაღებად კონკრეტულ სპეციალობაში სახელმწიფო სასერტიფიკაციო გამოცდაზე დაიშვება:
ა) პირი, რომელსაც შესაბამის სპეციალობაში დასრულებული აქვს პროფესიული მზადების - რეზიდენტურის პროგრამა სახელმწიფო ლიცენზიის მქონე სამედიცინო სასწავლო, სამეცნიერო-კვლევით ან სხვა დაწესებულებაში;
ბ)ექიმ-სპეციალისტი, რომელიც მუშაობს მოცემული სპეციალობით ან ბოლო 5 წლის განმავლობაში მუშაობდა საქართველოს ან უცხოეთის რომელიმე ქვეყნის სამეცნიერო-კვლევით, სპეციალიზებულ ან ზოგადი პროფილის სტაციონარული ან ამბულატორიული (მათ შორის დისპანსერული) ტიპის დიაგნოსტიკურ, სამკურნალო ან სარეაბილიტაციო პროფილაქტიკური პროფილის დაწესებულებაში და წარმოადგენს შესაბამისი პროფილით პროფესიული, პედაგოგიური, სამეცნიერო კვალიფიკაციის დამადასტურებელ დოკუმენტებს;
გ) პირი, რომელსაც შესაბამისი სპეციალობით დასრულებული აქვს პროფესიული მზადება კლინიკურ ორდინატურაში, ინტერნატურაში, სპეციალიზაციის კურსით, კლინიკურ ასპირანტურაში, დოქტორანტურაში.
მუხლი 20. „ექიმი - სპეციალისტის“ სახელმწიფო სერტიფიკატის მფლობელს შეუძლია სხვა სპეციალობის „ექიმი-სპეციალისტის“ სერტიფიკატის მიღებაც; ამისათვის იგი უნდა აკმაყოფილებდეს მე - 19 მუხლის პირობებს.
მუხლი 21. 1998 წლიდან „ზოგადი პროფილი ექიმის“ სახელმწიფო სერტიფიკატის ფლობა სავალდებულოა სახელმწიფო აკრედიტაციის მქონე უმაღლესი სამედიცინო სასწავლებლების იმ კურსდამთავრებულებისათვის (სრული უმაღლესი სამედიცინო განათლებისა და ზოგადი კლინიკური მზადების დასრულების შემდეგ), რომლებსაც სურთ:
ა) დამოუკიდებელი საექიმო საქმიანობის დაწყება „ზოგადი პროფილის ექიმის“ სპეციალობით;
ბ) გააგრძელონ პროფესიული მზადება რეზიდენტურის პროგრამით.
მუხლი 22. სერტიფიკატის მაძიებლის სამედიცინო სპეციალობას განსაზღვრავს:
ა) უმაღლესი სამედიცინო განათლების პროფილისა და პროფესიული მზადების (რეზიდენტურა, კლინიკური ორდინატურა, კლინიკური ასპირანტურა, ინტერნატურა, სპეციალიზაციის, დახელოვნებისა და კვალიფიკაციის ასამაღლებელი კურსები) დოკუმენტები;
ბ) საკანდიდატო ან სადოქტორო დისერტაციების გრიფი;
გ) უკანასკნელ წლებში (არანაკლებ შესაბამის საექიმო სპეციალობაში რეზიდენტურის ხანგრძლივობისა) პრაქტიკული საექიმო საქმიანობის პროფილი;
მუხლი 23. საექიმო სპეციალობაში სახელმწიფო სერტიფიკატის მოქმედების ვადა განისაზღვრება 5 წლით. აღნიშნული ვადის გასვლის შემდეგ სახელმწიფო სერტიფიკატით მინიჭებული უფლებამოსილების დადასტურება ხდება ხელახალი სერტიფიცირების (რესერტიფიცირების) მეშვეობით;
თავი III.
საშუალო სამედიცინო პერსონალის სახელმწიფო სერტიფიკატი
მუხლი 24. ამოღებულია
მუხლი 25. საშუალო სამედიცინო პერსონალის სახელმწიფო სერტიფიკატი ენიჭება საქართველოს იმ მოქალაქეს, რომელსაც საშუალო სამედიცინო განათლება მიღებული აქვს სახელმწიფო ლიცენზიის მქონე საშუალო სამედიცინო სასწავლებელში, ჩააბარა სახელმწიფო სასერტიფიკაციო გამოცდა და წარმოდგენილი აქვს ამ დებულების მე - 6 მუხლით გათვალისწინებული დოკუმენტები.
მუხლი 26. საშუალო სამედიცინო პერსონალის სახელმწიფო სერტიფიკატი გაიცემა საქართველოს შრომის, ჯანმრთელობისა და სოციალური დაცვის სამინისტროს მიერ დამტკიცებულ სპეციალობებში.
მუხლი 27. საშუალო სამედიცინო პერსონალს დამოუკიდებელი საქმიანობის უფლება ეძლევა მხოლოდ სერტიფიკატით განსაზღვრულ სპეციალობაში. შესაბამისი სერტიფიკატების ფლობის შემთხვევაში უფლება შეიძლება ვრცელდებოდეს ორ და მეტ სპეციალობაში მუშაობაზე.
მუხლი 28. სახელმწიფო სერტიფიკატი გაიცემა საბჭოს გადაწყვეტილებით.
მუხლი 29. სერტიფიკაციის დროს მაძიებლის სამედიცინო სპეციალობის განსაზღვრა ხდება:
ა) საშუალო სამედიცინო განათლებისა და დიპლომისშემდგომი მზადების (სპეციალიზაციის, დახელოვნებისა და კვალიფიკაციის ასამაღლებელი კურსები) შესახებ წარმოდგენილი დოკუმენტების საფუძველზე;
ბ) ბოლო 5 წლის განმავლობაში პრაქტიკულ საქმიანობის პროფილის მიხედვით.
მუხლი 30. საშუალო სამედიცინო პერსონალის სახელმწიფო სერტიფიკატის მოქმედების ვადას თითოეულ სპეციალობაში განსაზღვრავს საბჭო და ამტკიცებს საქართველოს შრომის, ჯანმრთელობისა და სოციალური დაცვის მინისტრი. აღნიშნული ვადის გასვლის შემდეგ სახელმწიფო სერტიფიკატით მინიჭებული უფლებამოსილების ხელახალი დადასტურება ხდება რესერტიფიკაციის მეშვეობით
თავი IV.
უმაღლესი ფარმაცევტული განათლების სპეციალისტის სახელმწიფო სერტიფიკატი
მუხლი 31. 1998 წლიდან უმაღლესი განათლების სპეციალისტ-ფარმაცევტის სახელმწიფო სერტიფიკატის ფლობა სავალდებულოა იმ პირისათვის, რომელიც იწყებს ფარმაცევტულ საქმიანობას ან იცვლის სამუშაო ადგილს ან იკავებს უფრო მაღალ თანამდებობას.
მუხლი 32. სახელმწიფო სერტიფიკატი ენიჭება საქართველოს იმ მოქალაქეს, რომელსაც განათლება მიღებული აქვს სახელმწიფო აკრედიტაციისა და ლიცენზიის მქონე უმაღლეს ფარმაცევტულ სასწავლებელში, ფაკულტეტზე ან სექტორზე, ჩაბარებული აქვს სახელმწიფო სასერტიფიკაციო გამოცდა და წარმოდგენილი აქვს ამ დებულების მე-6 მუხლში აღნიშნული დოკუმენტები.
მუხლი 33. ფარმაცევტის საქმიანობის თავისებურებიდან გამომდინარე, სერტიფიკატი შეიძლება იყოს ზოგადი პროფილის ფარმაცევტისა და ფარმაცევტსპეციალისტის. ფარმაცევტსპეციალისტის სერტიფიკატი გაიცემა შემდეგ სპეციალობებში:
ა) ფარმაცევტორგანიზატორი;
ბ) ფარმაცევტტექნოლოგი;
გ) ფარმაცევტანალიტიკოსი;
დ) ფარმაცევტტოქსიკოლოგი.
მუხლი 34. დამოუკიდებელი ფარმაცევტული საქმიანობა ნებადართულია მხოლოდ უმაღლესი ფარმაცევტული განათლების სპეციალისტისათვის სახელმწიფო სერტიფიკატით განსაზღვრულ სპეციალობაში. შესაბამისი სერტიფიკატების ფლობის შემთხვევაში უფლება შეიძლება ვრცელდებოდეს ორ და მეტ სპეციალობაში მუშაობაზე.
მუხლი 35. ფარმაცევტის სახელმწიფო სერტიფიკატი გაიცემა საბჭოს გადაწყვეტილებით სასერტიფიკაციო გამოცდების (სამინისტროს მიერ დამტკიცებული პროგრამისა და შეფასების კრიტერიუმების მიხედვით ჩატარებული) შედეგების და წარმოდგენილი საბუთების განხილვის საფუძველზე.
მუხლი 36. სპეციალისტ-ფარმაცევტის სახელმწიფო სერტიფიკატი სახელმწიფო სასერტიფიკაციო გამოცდის ჩაბარების გარეშე გამონაკლისის სახით შეიძლება გაიცეს საქართველოს იმ მოქალაქეებზე, რომლებსაც 1997 წლის 1 ნოემბრამდე მინიჭებულ აქვთ ფარმაცევტულ მეცნიერებათა დოქტორის სამეცნიერო ხარისხი და გააჩნიათ უკანასკნელი 10 წლის განმავლობაში შესაბამისი სპეციალობით მუშაობის არა ნაკლებ 5 წლის სტაჟი ან კანდიდატი სამეცნიერო ხარიხსი და უკანასკნელი 15 წლის განმავლობაში შესაბამისი სპეციალობით მუშაობის არა ნაკლებ 10 წლის სტაჟი.
მუხლი 37. „ზოგადი პროფილის ფარმაცევტის“ სახელმწიფო სერტიფიკატის მისაღებად სასერტიფიკაციო გამოცდაზე დაიშვება სახელმწიფო ლიცენზიისა და აკრედიტაციის მქონე უმაღლესი ფარმაცევტული სასწავლებლების, ფაკულტეტების, სექტორების კურსდამთავრებული.
მუხლი 38. კონკრეტული სპეციალობის მიხვედით ფარმაცევტის სახელმწიფო სერტიფიკატის მისაღებად სასერტიფიკაციო გამოცდაზე დაიშვება:
ა) პირი, რომელსაც შესაბამის სპეციალობაში დასრულებული აქვს პროფესიული მზადების პროგრამა სახელმწიფო ლიცენზიის მქონე ფარმაცევტულ სასწავლებელში, ფაკულტეტზე ან სექტორზე;
ბ) სამეცნიერო-კვლევით, სპეციალიზებულ ან ზოგადი პროფილის ფარმაცევტულ დაწესებულებებში ამჟამად ან ბოლო 5 წლის განმავლობაში მომუშავე ფარმაცევტი, რომელსაც გააჩნია შესაბამის სპეციალობაში პროფესიული, პედაგოგიური და სამეცნიერო კვალიფიკაციის დამადსტურებელი დოკუმენტები;
გ) პირი, რომლებსაც ბოლო 5 წლის განმავლობაში დასრულებული აქვს პროფესიული მზადება შესაბამისი სპეციალობით ასპირანტურაში, დოქტორანტურაში ან გავლილი აქვთ დარგობრივი სპეციალიზაცია.
მუხლი 39. ფარმაციის რომელიმე სპეციალობაში სახელმწიფო სერტიფიკატის მფლობელს შეუძლია სხვა სპეციალობის სერტიფიკატის მიღება. ამისათვის მან უნდა გაიაროს შესაბამისი სპეციალობით პროფესიული მზადების - დარგობრივი სპეციალიზაციის პროგრამა.
მუხლი 40. 1998 წლიდან ”ზოგადი პროფილის ფარმაცევტის“ სახელმწიფო სერტიფიკატის მიღება სავალდებულოა სახელმწიფო აკრედიტაციის მქონე უმაღლესი ფარმაცევტული სასწავლებლების იმ კურსდამთავრებულისათვის, რომელსაც სურს:
ა) „ზოგადი პროფილის ფარმაცევტის“ სპეციალობით საქმიანობა;
ბ)გააგრძელოს პროფესიული მზადება ფარმაციის ერთ-ერთ სპეციალობაში.
მუხლი 41. სერტიფიკაციის დროს მაძიებლის სპეციალობის განსაზღვრა ხდება:
ა) უმაღლესი ფარმაცევტული განათლების პროფილისა და პროფესიული მზადების (დოქტორანტურა, ასპირანტურა, სპეციალიზაციის, დახელოვნებისა და კვალიფიკაციის ასამაღლებელი კურსები) დოკუმენტების საფუძველზე;
ბ) საკანდიდატო ან სადოქტორო დისერტაციების გრიფის საფუძველზე;
გ) უკანასკნელ წლებში (არანაკლებ შესაბამის ფარმაცევტულ სპეციალობაში რეზიდენტურის ხანგრძლივობისა) პრაქტიკული ფარმაცევტული საქმიანობის პროფილის მიხედვით;
მუხლი 42. ფარმაცევტის სახელმწიფო სერტიფიკატის მოქმედების ვადა განისაზღვრება 5 წლით. აღნიშნული ვადის გასვლის შემდეგ სახელმწიფო სერტიფიკატით მინიჭებული უფლებამოსილების დადასტურება ხდება ხელახალი სერტიფიცირების (რესერტიფიცირების) მეშვეობით;
თავი V.
საშუალო ფარმაცევტული განათლების სპეციალისტის სახელმწიფო სერტიფიკატი
მუხლი 43. ამოღებულია.
მუხლი 44. სახელმწიფო სერტიფიკატი შეიძლება მიენიჭოს საქართველოს იმ მოქალაქეს, რომელსაც განათლება მიღებული აქვს სახელმწიფო აკრედიტაციისა და ლიცენზიის მქონე საშუალო სპეციალურ სასწავლებელში, ჩაბარებული აქვს საშუალო ფარმაცევტული განათლების სპეციალისტის სახელმწიფო სასერტიფიკაციო გამოცდა და წარმოდგენილი აქვს ამ დებულების მე - 6 მუხლში აღნიშნული დოკუმენტები.
მუხლი 45. საშუალო ფარმაცევტული განათლების სპეციალისტის სახელმწიფო სერტიფიკატის მინიჭება ხდება საბჭოს გადაწყვეტილებით სასერტიფიკაციო გამოცდის (სამინისტროს მიერ დამტკიცებული პროგრამისა და შეფასების კრიტერიუმების მიხედვით ჩატარებული) შედეგისა და წარმოდგენილი საბუთების განხილვის საფუძველზე.
მუხლი 46. საშუალო ფარმაცევტული განათლების სპეციალისტის სახელმწიფო სერტიფიკატის მოქმედების ვადას განსაზღვრავს საბჭო და ამტკიცებს საქართველოს შრომის, ჯანმრთელობისა და სოციალური დაცვის მინისტრი. აღნიშნული ვადის გასვლის შემდეგ სახელმწიფო სერტიფიკატით მინიჭებული უფლებამოსილების ხელახალი დადასტურება ხდება რესერტიფიკაციის მეშვეობით.
თავი VI.
უმაღლესი და საშუალო სამედიცინო და ფარმაცევტული
პერსონალისათვის სახელმწიფო სერტიფიკატის მიმნიჭებელი საბჭო
მუხლი 47. საქართველოში სამედიცინო და ფარმაცევტული პერსონალის სერტიფიკაციის (რესერტიფიკაციის) პროცესს ხელმძღვანელობს „საბჭო“, შრომის, ჯანმრთელობისა და სოციალური დაცვის მინისტრის თავმჯდომარეობით.
მუხლი 48. სამედიცინო და ფარმაცევტულ პერსონალს სერტიფიკატი ენიჭება წინამდებარე დებულებითა და საბჭოს მიერ შემუშავებული და მინისტრის მიერ დამტკიცებული წესებით.
მუხლი 49. „საბჭოს“ შემადგენლობაში შედის 25 წევრი, რომელთა წარმომადგენლობა განისაზღვრება შემდეგნაირად:
ა) „სამინისტროს“ -6 წევრი;
ბ) უმაღლეს სამედიცინო საგანმანათლებლო დაწესებულებებს -5 წევრი;
გ) იმ სახელმწიფო უწყებებს, რომლებსაც გააჩნიათ სამედიცინო სამსახური -3 წევრი;
დ) ექიმთა პროფესიულ ასოციაციებს - 7 წევრი;
ე) საზოგადოებრიობას -2 წევრი;
ვ) სამედიცინო დაწესებულებებს - 2 წევრი;»
მუხლი 50. „საბჭო“ ვალდებულია:
ა) განიხილოს და წარუდგინოს სამინისტროს დასამტკიცებლად სამედიცინო და ფარმაცევტული პერსონალისათვის სერტიფიკატის მინიჭების წესები;
ბ) განიხილოს სასერტიფიკაციო გამოცდების ჩატარების პროცედურა, გამოცდების ვადები და წარუდგინოს ისინი დასამტკიცებლად სამინისტროს;
გ) დაამტკიცოს დარგობრივი საგამოცდო კომისიების შემადგენლობა;
დ) დაამყაროს მჭიდრო კონტაქტები პროფესიულ საზოგადოებრივ გაერთიანებებთან;
ე) წარსდგეს სამინისტროს წინაშე თავისი საქმიანობის ყოველწლიური ანგარიშით.
მუხლი 51. საბჭო უფლებამოსილია:
ა) ადრე გაცემული სერტიფიკატის მოქმედების ვადის დამთავრების შემდეგ, სამედიცინო და ფარმაცევტული პერსონალის კვალიფიკაციის პერიოდული გადამოწმების მიზნით დადგენილ ვადებში ჩაატაროს სამედიცინო და ფარმაცევტული კადრების რესერტიფიკაცია და მისი შედეგების გათვალისწინებით განსაზღვროს სამედიცინო და ფარმაცევტული საქმიანობის მოქმედების შეწყვეტა ან გაგრძელება ახალი ვადით;
ბ) მონაწილეობა მიიღოს პაციენტის ან მისი ახლობლების მიერ აღძრული საჩივრის განხილვასა (რომელიც დაკავშირებულია სერტიფიკატის მქონე სამედიცინო და ფარმაცევტული პერსონალის საქმიანობასთან) და შესაბამისი ექსპერტიზის ჩატარებაში კანონმდებლობით დადგენილი წესით;
გ) გადაამოწმოს მაძიებლის მიერ წარდგენილი ნებისმიერი დოკუმენტი და ინფორმაცია.
მუხლი 51.1 „საბჭოს“ სხდომები იმართება თავმჯდომარის მოწვევით, არაუმცირეს კვარტალში ერთხელ ან „საბჭოს“ სიითი შემადგენლობის ერთი მესამედის მოთხოვნით.
მუხლი 51.2 . „საბჭო“ უფლებამოსილია თუ სხდომას ესწრება „საბჭოს“ წევრთა ორი მესამედი. „საბჭოს“ გადაწყვეტილება მიიღება წევრთა სიითი შემადგენლობის უმრავლესობით (ღია ან ფარული კენჭისყრით), ხმათა თანაბრობისას გადამწყვეტია თავმჯდომარის ხმა.
მუხლი 51.3 „საბჭოს“ გადაწყვეტილება ფორმდება ოქმით, რომელსაც ხელისმოწერით ადასტურებენ თავმჯდომარე და მდივანი.
მუხლი 51.4 „საბჭოს“ თავმჯდომარის არყოფნის შემთხვევაში სხდომას ხელმძღვანელობს მისი მოადგილე.
თავი VII.
მოთხოვნები სამედიცინო და ფარმაცევტული
საქმიანობისათვის სახელმწიფო სერტიფიკატის მაძიებლისადმი
მუხლი 52. სამედიცინო და ფარმაცევტული საქმიანობის სახელმწიფო სერტიფიკატის მაძიებელმა დიპლომისშემდგომი განათლების სახელმწიფო სამედიცინო აკადემიაში უნდა წარუდგინოს სათანადო დოკუმენტები.
მუხლი 53. მაძიებლის ჯანმრთელობის მდგომარეობა და პროფესიული მომზადების დონე უნდა უზრუნველყოფდეს დამოუკიდებელი სამედიცინო და ფარმაცევტული საქმიანობის წარმართვას პროფესიული სტანდარტების დონეზე.
მუხლი 54. მაძიებელი პასუხიმგებელია მის მიერ წარმოდგენილი ყველა დოკუმენტის სისწორეზე.
მუხლი 55. მაძიებელი პირადად უნდა წარსდგეს დოკუმენტების განხილვის დროს გამოცდაზე.
თავი VIII.
უცხოეთის ქვეყნების სამედიცინო და ფარმაცევტული
სასწავლებლების კურსდამთავრებულთათვის საქართველოში
სამედიცინო და ფარმაცევტული საქმიანობისათვის სერტიფიკატის გაცემის წესები
მუხლი 56. სამედიცინო ან ფარმაცევტული საქმიანობის სერტიფიკატის მაძიებელმა საქართველოს მოქალაქემ, რომელსაც სამედიცინო ან ფარმაცევტული განათლება და/ან პროფესიული მზადება 1991 წლის შემდეგ გავლილი აქვს საქართველოს ფარგლებს გარეთ, საერთო მოთხოვნების გარდა დამატებით უნდა წარმოადგინოს:
ა) უცხოეთის სასწავლებლის მიერ გაცემული სამედიცინო ან ფარმაცევტული განათლებისა და პროფესიული მზადების დამთავრების დამადასტურებელი ოფიციალური დოკუმენტი;
ბ) სასწავლო დისციპლინების ჩამონათვალი და საათობრივი დატვირთვა.
მუხლი 57. თუ მაძიებელს სერტიფიკატი (ან მისი ექვივალენტი) მიღებული აქვს სხვა ქვეყანაში, მაშინ „საბჭო“ წარმოდგენილი საბუთების განხილვის საფუძველზე უფლებამოსილია წინამდებარე დებულების მე-17 და 36-ე მუხლების შესაბამისად გასცეს საქართველოს სახელმწიფო სერტიფიკატი სასერტიფიკაციო გამოცდის ჩაბარების გარეშე.
მუხლი 58. მაძიებელი უნდა ფლობდეს საქართველოს სახელმწიფო ენას (იგულისხმება მეტყველება და წერა), ოფიციალური დოკუმენტაციის წარმოებისა და პაციენტთან, მის ახლობლებთან და კოლეგებთან საქმიანი ურთიერთობისათვის.
მუხლი 59. უცხო ენაზე წარმოდგენილ (გარდა რუსული ენისა) ყველა დოკუმენტს (დიპლომები, მოწმობები და სხვა) უნდა დაერთოს სახელმწიფო ენაზე ნოტარიულად დამოწმებული ასლი.
მუხლი 60. თუ მაძიებელს საბჭოს გადაწყვეტილებით არ ეძლევა სერტიფიკატი გამოცდების ჩაბარების გარეშე, ისე ვალდებულია ჩააბაროს სახელმწიფო სასერიტიფიკაციო გამოცდა დადგენილი წესით.
თავი IX.
სხვა ქვეყნის მოქალაქეობის მქონე
სამედიცინო და ფარმაცევტული პერსონალისათვის
საქართველოს ტერიტორიაზე სამედიცინო და ფარმაცევტული
საქმიანობის დროებითი სახელმწიფო სერიტიფიკატის გაცემის წესი
მუხლი 61. სხვა ქვეყნის მოქალაქეს შეუძლია აწარმოოს საქართველოს ტერიტორიაზე სამედიცინო ან ფარმაცევტული საქმიანობა მხოლოდ დროებითი სახელმწიფო სერტიფიკატის საფუძველზე.
მუხლი 62. მაძიებელმა უნდა დააკმაყოფილოს იმიგრაციის შესახებ კანონმდებლობით გათვალისწინებული შესაბამისი მოთხოვნა.
მუხლი 63. დროებითი სახელმწიფო სერტიფიკატი გაიცემა 1 წლამდე ვადით;
თავი X.
დისციპლინური ღონისძიებები
უმაღლესი და საშუალო სამედიცინო და ფა რმაცევტული
პერსონალის მიმართ, რომელთაც მინიჭებული აქვთ სახელმწიფო სერტიფიკატი
მუხლი 64. საბჭო იღებს გადაწყვეტილებას სერტიფიკატის მოქმედების შეჩერებაზე (ერთი თვიდან ერთ წლამდე ვადით) სავალდებულო რიგგარეშე რესერტიფიკაციით ან მის გარეშე, თუ მისი მფლობელი არღვევს სერტიფიკატით ნებადარულ სამედიცინო და ფარმაცევტული საქმიანობისათვის კანონმდებლობით დადგენილ მოთხოვნებს.
მუხლი 65. გადაწყვეტილება სერტიფიკატის მოქმედების შეჩერების შესახებ დაუყოვნებლივ წერილობით ეცნობება მის მფლობელს სერტიფიკატის შეჩერების მოტივისა და საფუძვლის მითითებით და აღინიშნება სასარეტიფიკაციო რეესტრში.
მუხლი 66. სერტიფიკატის მოქმედების შეჩერება ნიშნავს სერტიფიკატით ნებადართული სამედიცინო და ფარმაცევტული საქმიანობის განხორციელების აკრძალვას სერტიფიკატის განახლებამდე.
მუხლი 67. სერტიფიკატის მოქმედების შეჩერებასთან დაკავშირებული პირობებისა და მოთხოვნების შესრულების შემდეგ სერტიფიკატის მოქმედება განახლდება საბჭოს გადაწყვეტილებით, სერტიფიკატის მფლობელის ან მისი წარმომადგენლის განცხადების საფუძველზე.
მუხლი 68. გადაწყვეტილება სერტიფიკატის მოქმედების შეჩერების შესახებ შეიძლება გასაჩივრდეს სასამართლოში საქართველოს კანონმდებლობის შესაბამისად.
მუხლი 69. სერტიფიკატის მოქმედების განახლების შესახებ გადაწყვეტილება შეიტანება სასერტიფიკაციო რეესტრებში.
მუხლი 70. სერტიფიკატის გაუქმების საფუძველია:
ა) სერტიფიკატის მფლობელის წერილობითი მოთხოვნა;
ბ) სერტიფიკატის მფლობელის გარდაცვალება;
გ) სერტიფიკატის მოქმედების შეჩერების ვადის გასვლა, მოქმედების აღდგენის საფუძვლის არსებობისას.
დ) სპეციალური კანონით გათვალისწინებული სხვა საფუძვლები;
ე) სერტიფიკატის მფლობელის მიერ ნებადართული სამედიცინო და ფარმაცევტული საქმიანობის განხორციელებისათვის კანონმდებლობით დადგენილი წესების სისტემატური (სამი და მეტი) დარღვევა.
მუხლი 71. 70-ე მუხლის პირველი პუნქტის „გ“ „დ“ და „ე“ ქვეპუნქტებით გათვალისწინებულ შემთხვევებში გადაწყვეტილება სერტიფიკატის გაუქმების შესახებ მიიღება საქართველოს კანონმდებლობის შესაბამისად.
მუხლი 72. სერტიფიკატის გაუქმების შესახებ, „საბჭო“ , მისი გაუქმების საფუძვლების მითითებით, წერილობით აცნობებს სერტიფიკატის მფლობელს; სათანადო ცვლილებები შედის სასერტიფიკაციო რეესტრში.
თავი XI.
სახელმწიფო სასერტიფიკაციო გამოცდის ჩატარების წესები
მუხლი 73. სახელმწიფო სასერტიფიკაციო გამოცდები ტარდება სამინისტროს მიერ დამტკიცებულ უმაღლეს და საშუალო სამედიცინო და ფარმაცევტულ სპეციალობებში.
მუხლი 74. სასერტიფიკაციო გამოცდების ორგანიზაციას ახორციელებს დიპლომისშემდგომი განათლების სახელმწიფო სამედიცინო აკადემია, ექიმთა და დარგობრივ ასოციაციებთან თანამშრომლობითა და საქართველოს შრომის, ჯანმრთელობისა და სოციალური დაცვის სამინისტროს შესაბამისი სამსახურის ხელმძღვანელობით.
მუხლი 75. სამედიცინო და ფარმაცევტული საქმიანობის სერტიფიკატის მაძიებელმა დიპლომისშემდგომი განათლების სახელმწიფო სამედიცინო აკადემიაში დადგენილი ფორმის განცხადებასთან ერთად უნდა წარადგინოს:
ა) განათლების დამადასტურებელი საბუთის (დიპლომი) ასლი;
ბ) ამონაწერი შრომის წიგნაკიდან (საჭიროების შემთხვევაში - შეთავსებით მუშაობის დამადასტურებელი საბუთი);
გ) რეზიდენტურის, კლინიკური ორდინატურის, ინტერნატურის, ასპირანტურის, დოქტორანტურის დამთავრების, სპეციალიზაციის, დახელოვნების და კვალიფიკაციის ასამაღლებელი კურსების გავლის დამადასტურებელი მოწმობის ასლი;
დ) მეცნიერებათა კანდიდატის ან დოქტორის დიპლომის ასლი;
ე) კადრების აღრიცხვის ფურცელი;
ვ) სახელმწიფო სასერტიფიკაციო მოსაკრებლის გადახდის დამადასტურებელი საბუთი;
ზ) უკანასკნელი 3 წლის პრაქტიკული მუშაობის ანგარიში დამოწმებული დაწესებულების ხელმძღვანელის ან შესაბამისი დარგის პროფესიული ასოციაციის ან სამედიცინო სტატისტიკის სამსახურის მიერ (ანგარიში სავალდებულოდ უნდა შეიცავდეს ცნობებს: შესრულებული სამუშაოების მოცულობის თაობაზე, სპეციალისტის საქმიანობის ეფექტურობისა და შედეგიანობის შესახებ, სამედიცინო შეცდომების ანალიზის, პაციენტების მადლობების თაობაზე, პროფესიული კომპეტენტურობის ამაღლების შესახებ - სპეციალიზაციისა და კვალიფიკაციის ამაღლების კურსების გავლა, სტაჟირება, სამეცნიერო და პრაქტიკულ კონფერენციებში მონაწილეობა, სამეცნიერო და სამეცნიერო-პრაქტიკული ხასიათის პუბლიკაციების შესახებ დ ა.შ.);
თ) წარდგინება - რეკომენდაციები:
ან საქართველოში ლიცენზირებული ერთი ან რამოდენიმე სამედიცინო ან ფარმაცევტული დაწესებულების;
ან შესაბამისი დარგობრივი პროფესიული ასოციაციის;
ან საქართველოში ლიცენზირებული ორი და მეტი შესაბამისი დარგის სპეციალისტისაგან;
ან დახასიათება - რეკომენდაცია სასწავლო დაწესებულებიდან (ახალკურსდამთავრებულებისათვის).
წარდგინება-რეკომენდაციაში ასახული უნდა იყოს ცნობები - რეკომენდატორის შესახებ, ლიცენზიის მაძიებელთან რეკომენდატორის საქმიანი ურთიერთობების შესახებ, ამასთანავე რეკომენდაციაში დახასიათებული უნდა იყოს მაძიებლის საქმიანი და პროფესიული თვისებები (პროფესიული ჩვევები, პასუხიმგებლობის გრძნობა და სხვა);
დეონტოლოგიური პრინციპების ცოდნა და პრაქტიკაში მათი გამოყენების უნარჩვევები;
მედიცინის თანამედროვე მიღწევების პრაქტიკულად გამოყენების უნარი;
ამა თუ იმ სპეციალობის ფლობის მოცულობა;
სრულყოფილად დაუფლებული მეთოდები და მეთოდიკები;
ათვისებული უნიკალური მეთოდები, ხერხები თუ ტექნოლოგიები;
პიროვნული თვისებები და ა.შ.
ი) ფიზიკური ჯანმრთელობის მდგომარეობის დამადასტურებელი საბუთი;
კ) ფსიქიკური ჯანმრთელობის მდგომარეობის დამადასტურებელი საბუთი.
მუხლი 76. დიპლომის შემდგომი განათლების სახელმწიფო სამედიცინო აკადემიის სერტიფიკაციის სამსახურში ამოწმებენ განცხადებისა და თანმხლები საბუთების შესაბამისობას დადგენილ მოთხოვნებთან და არეგისტრირებენ განცხადების შემოსვლის თარიღს. ამავე დროს სერტიფიკატის მაძიებელს დაენიშნება სასერტიფიკაციო გამოცდის ვადა დამტკიცებული გრაფიკის შესაბამისად.
მუხლი 77. გამოცდების დაწყების წინ თითოეულ სერტიფიკატის მაძიებელზე დიპლომისშემდგომი განათლების სახელმწიფო სამედიცინო აკადემიის სერტიფიკაციის სამსახურის მიერ გაიცემა საგამოცდო ფურცელი, რომელშიც აღინიშნება მაძიებლის სახელი, გვარი, პასპორტის ან მისი შემცვლელი პირადობის დამადასტურებელი მოწმობის ნომერი, გამოცდების თარიღი.
მუხლი 78. სერტიფიკატის მაძიებელი გამოცდაზე უნდა გამოცხადდეს დადგენილ დროს და თან უნდა იქონიოს საგამოცდო ფურცელი, პასპორტი ან მისი შემცვლელი პირადობის დამადასტურებელი მოწმობა და შავი ფერის ბურთულიანი კალმისტარი.
მუხლი 79. უნიფიცირებული სახელმწიფო სასერტიფიკაციო გამოცდა დებულების მიხედვით ეწყობა ერთ ეტაპად.
მუხლი 80. განრიგით დანიშნულ გამოცდაზე გამოუცხადებლობის შემთხვევაში მაძიებლის ავადმყოფობის გამო, წინასწარ ან გამოცდის დღეს 1500 საათამდე დიპლომისშემდგომი განათლების სახელმწიფო სამედიცინო აკადემიის სერტიფიკაციის სამსახურს უნდა წარედგინოს პირადი განცხადება და ავადმყოფობის დამადასტურებელი ცნობა.
ა) გამოჯანმრთელების შემდეგ მაძიებელი მიმართავს დიპლომისშემდგომი განათლების სახელმწიფო სამედიცინო აკადემიის სერტიფიკაციის სამსახურს განცხადებით გამოცდის გადავადების თაობაზე, რასაც თან უნდა ერთვოდეს ცნობა გამოჯამრთელების შესახებ;
ბ) გამოცდის გადავადება დასაშვები სახელმწიფო სასერტიფიკაციო გამოცდების მხოლოდ იმავე სასესიო პერიოდში.
მუხლი 81. გამოცდაზე შესვლისას, ბილეთის მიღებამდე თუ მაძიებელი თავს ცუდად გრძნობს მას სურვილისამებრ შეუძლია გააგრძელოს ან გადაიტანოს გამოცდა მუხლი 82-ის ა) და ბ) პუნქტების შესაბამისად.
მუხლი 82. საგამოცდო ბილეთის მიღების ან ბილეთზე მუშაობის დაწყების შემდეგ მაძიებელი კარგავს გამოცდის გადავადების უფლებას.
მუხლი 83. უნიფიცირებულ სახელმწიფო სასერტიფიკაციო გამოცდაზე მაძიებელი იღებს ტესტურ ბილეთს, რომლის შედგენა ხდება კომპიუტერზე. ბილეთი შეიცავს 200 ტესტ-კითხვას, მასში აღინიშნება მაძიებლის ვინაობა, სპეციალობა, გამოცდის თარიღი. ბილეთის გარდა მაძიებელი მაშინვე იღებს ფურცლებს „შავი“ სამუშაოსათვის.
მუხლი 84. სასერტიფიკაციო გამოცდას ეთმობა 3 საათი. დროის აღრიცხვა იწყება ბილეთის მიღებიდან.
მუხლი 85. გამოცდის დამთავრების შემდეგ შევსებული ტესტ-ბილეთები ბარდება დარბაზის კურატორს.
მუხლი 86. ტესტური გამოცდების პასუხების შეფასებისას მოწმდება თავად ტესტში შემოხაზული პასუხები, სპეციალური ტრაფარეტის მეშვეობით, რისთვისაც შეიძლება გამოყენებული იყოს აგრეთვე კომპიუტერი. გასწორებული ტესტური ბილეთის დედანი და მაძიებლის საგამოცდო ფურცელი ინახება დიპლომისშემდგომი განათლების სახელმწიფო სამედიცინო აკადემიის სერტიფიკაციის სამსახურში, სერტიფიკატის მაძიებლის სხვა მასალებთან ერთად.
მუხლი 87. დამაკმაყოფილებლად ითვლება ნაშრომი, რომელშიც ტესტების 75%25-ზე მეტზე გაცემულია სწორი პასუხი.
მუხლი 88. გამოცდის მიმდინარეობის პროცესში დაუშვებელია მაძიებლებს შორის ლაპარაკი, ადგილიდან ადგომა, კონსპექტების, სახელმძღვანელოების და სხვა ლიტერატურის გამოყენება, „შავი“ ფურცლების და ბილეთის გადაწოდება. აღნიშნული დარღვევებისათვის მაძიებელი იხსნება გამოცდიდან და მას უფორმდება არადამაკმაყოფილებელი შეფასება.
მუხლი 89. გამოცდის დროს დარბაზში შეიძლება იმყოფებოდნენ საბჭოს წევრები, შრომის, ჯანმრთელობისა და სოციალური დაცვის სამინისტროს შესაბამისი სამსახურის, დიპლომისშემდგომი განათლების სახელმწიფო სამედიცინო აკადემიის სერტიფიკაციის სამსახურის წარმომადგენლები, საგამოცდო კომისიის თავმჯდომარე. მეტი საჯაროობისა და გამჭირვალობის მიზნით დასაშვებია საბჭოს მიერ სპეციალურად მოწვეული საზოგადოებრიობისა და მასმედიის წარმომადგენელთა დასწრებაც.
მუხლი 90. გამოცდის შედეგები ცხადდება გამოცდის ჩაბარებიდან არა უგვიანეს 24 საათის განმავლობაში. სასერტიფიკაციო გამოცდის შედეგების გამოცხადებისთანავე ერთი საათის განმავლობაში მაძიებელს წერილობითი განცხადების საფუძველზე (თავისი სურვილითა და ხარჯებით) შეუძლია მიიღოს უკვე გასწორებული თავისი ნაშრომის ქსეროასლი.
მუხლი 91. გამოცდის შეფასების აპელაცია დასაშვებია მხოლოდ გამოცდის შედეგების გამოცხადების შემდეგი დღის 12 საათამდე, რისთვისაც მაძიებელი სათანადო განცხადებით მიმართავს საგამოცდო კომისიის თავმჯდომარეს. ეს უკანასკნელი მაძიებლებთან ერთად ხელახალ ასწორებს ნაშრომს შესაბამისი ტრაფარეტის მიხედვით. საგამოცდო კომისიის თავმჯდომარის გადაწყვეტილება საბოლოოა, ხელმეორედ განხილვას აღარ ექვემდებარება და შეიძლება გასაჩივრდეს სასამართლოში მოქმედი კანონმდებლობის მიხედვით.
მუხლი 92. სასერტიფიკაციო გამოცდების შედეგებს დიპლომისშემდგომი განათლების სახელმწიფო სამედიცინო აკადემიის სერტიფიკაციის სამსახური ოპერატიულად აწვდის შრომის, ჯანმრთელობისა და სოციალური დაცვის სამინისტროს შესაბამის სამსახურს, რომელიც იხილავს მათ და ახსენებს საბჭოს დასამტკიცებლად.
მუხლი 93. გამოცდაზე არადამაკმაყოფილებელი შეფასების მიღების ან საბჭოს გადაწყვეტილებით სერტიფიკატის გაცემაზე უარის თქმის შემთხვევაში სასერტიფიკაციო გამოცდის ხარჯების დასაფარად გადახდილი თანხა (თუკი ასეთი იყო) მაძიებელს უკან არ დაუბრუნდება.
მუხლი 94. განმეორებით სასერტიფიკაციო გამოცდაზე გასვლა შესაძლებელია არადამაკმაყოფილებელი შეფასების მიღებიდან არაუადრეს ექვსი თვისა;
მუხლი 95. საგამოცდო პროცედურის დარღვევის ან კომისიის მუშაობის დაბალი ხარისხის შემთხვევაში საბჭოს უფლება აქვს შეაჩეროს ან გააუქმოს გამოცდის შედეგები.
თავი X.
უმაღლესი არასამედიცინო განათლების
სამედიცინო პერსონალის სახელმწიფო სერტიფიკატი
მუხლი 96. უმაღლესი არასამედიცინო განათლების სამედიცინო პერსონალის (სპეციალისტის) სახელმწიფო სერტიფიკატი ენიჭება საქართველოს ან უცხო ქვეყნის მოქალაქეს ან მოქალაქეობის არმქონე პირს, რომელსაც მიღებული აქვს განათლება სახელმწიფო აკრედიტაციის მქონე ან საქართველოს მიერ აღიარებული უცხო ქვეყნის შესაბამის უმაღლეს სასწავლებელში, განათლების სამინისტროს მიერ დადგენილ სპეციალობებში.
მუხლი 97. უმაღლესი არასამედიცინო განათლების სამედიცინო პერსონალს ენიჭება „სპეციალისტის - არასამედიცინო უმაღლესი განათლებით“ სახელმწიფო სერტიფიკატი.
მუხლი 98. სპეციალისტის სერტიფიკატი გაიცემა განათლების სამინისტროს მიერ დამტკიცებულ სპეციალობებში.
მუხლი 99. „სპეციალისტის“ სახელმწიფო სერტიფიკატის მისაღებად კონკრეტულ სპეციალობაში სახელმწიფო სასერტიფიკაციო გამოცდაზე დაიშვება პირი:
ა) რომელსაც გააჩნია შესაბამისი უმაღლესი საგანმანათლებლო ცენზის დამადასტურებელი სახელმწიფო მოწმობა;
ბ) შესაბამის სპეციალობაში რეზიდენტურის ან ასპირანტურის კურსის გავლის დამადასტურებელი მოწმობა ან უცხო ქვეყნის ანალოგიური მოწმობა აღიარებული საქართველოს მიერ;
გ) შესაბამისი სპეციალობით მუშაობის დამადასტურებელი სახელმწიფო მოწმობა; ამასთან, მუშაობის სტაჟი არ უნდა იყოს შესაბამის სპეციალობაში რეზიდენტურის კურსის ხანგრძლივობაზე ნაკლები.*
მუხლი 100. სერტიფიკატის მაძიებლის სპეციალობას განსაზღვრავს:
ა) უმაღლესი განათლების პროფილი და დიპლომისშემდგომი პროფესიული მზადება;
ბ) საკანდიდატო ან სადოქტორო დისერტაციის გრიფი (მაძიებლებს, რომლებსაც 1997 წლის 1 ნოემბრამდე მინიჭებული აქვთ მეცნიერებათა კანდიდატის ან დოქტორის შესაბამისი სამეცნიერო ხარისხი);
გ) უკანასკნელ წლებში (არანაკლებ შესაბამის სპეციალობაში რეზიდენტურის ხანგრძლივობისა) პრაქტიკული საქმიანობის პროფილი.
მუხლი 101. „სპეციალისტის“ სახელმწიფო სერტიფიკატის მოქმედების ვადა განისაზღვრება 5 წლით. აღნიშნული ვადის გასვლის შემდეგ სახელმწიფო სერტიფიკატით მინიჭებული უფლებამოსილების დადასტურება ხდება ხელახალი სერტიფიცირების (რესერტიფიცირების) მეშვეობით.
დანართი 2
რეგისტრირებულია
საქართველოს იუსტიციის სამინისტროში
სარეგისტრაციო კოდი 470.230.000.11.119.005.279
მიღებულია 2002 წლის 3 მაის ს N142/ნ
საქართველოს შრომის, ჯანმრთელობისა და სოციალური დაცვის მინისტრის ბრძანება
საქართველოში სამკურნალო საშუალებების რეგისტრაციის წესის დამტკიცების შესახებ
საქართველოში სამკურნალო საშუალებების რეგისტრაციის წესი
1. წინამდებარე წესი, შესაბამისად საქართველოს კანონის „წამლის და ფარმაცევტული საქმიანობის შესახებ“, განსაზღვრავს სამკურნალო საშუალებების რეგისტრაციის/ხელახალი რეგისტრაციის და სავალდებულო შეტყობინების პროცედურას.
I. ზოგადი ნაწილი
2. საქართველოს ტერიტორიაზე ნებადართულია მხოლოდ შრომის, ჯანმრთელობის და სოციალური დაცვის სამინისტროს მიერ რეგისტრირებული სამკურნალო საშუალებების წარმოება, იმპორტი, გაცემაგამოყენება, გარდა საქართველოს კანონით “წამლის და ფარმაცევტული საქმიანობის შესახებ” დაშვებული გამონაკლისებისა.
3. სამკურნალო საშუალებების სახელმწიფო რეგისტრაციას ახორციელებს საქართველოს შრომის, ჯანმრთელობის და სოციალური დაცვის სამინისტრო (შემდგომში - სამინისტრო), წამლის და ფარმაცევტული საქმიანობის დეპარტამენტის მეშვეობით.
4. სამკურნალო საშუალებების რეგისტრაციის უფლება გააჩნია მხოლოდ მწარმოებელს ან მისი პროდუქციის სავაჭრო ლიცენზიის მფლობელს ე.წ. რეგისტრაციის უფლების მქონე სუბიექტს; გამონაკლისია ჰუმანიტარული მედიკამენტების რეგისტრაცია, სადაც დასაშვებია რეგისტრაციის მაძიებელი ჰუმანიტარული დახმარების დონორი იყოს (რეგისტრაციაზე უფლებამოსილი სუბიექტი და ჰუმანიტარული მედიკამენტების შემთხვევაში დონორი, შემდგომში მოიხსენიება როგორც რეგისტრაციის მაძიებელი).
5. საქართველოში სამკურნალო საშუალებების სახელმწიფო რეგისტრაციას ექვემდებარება:
ა) თერაპიული და დიაგნოსტიკური საშუალებები და მათი წამლის ფორმები;
ბ) ბიოლოგიური, სამკურნალო-პროფილაქტიკური და დიაგნოსტიკური პრეპარატები;
გ) იმუნობიოლოგიური პრეპარატები;
დ) თერაპიული ეფექტის მქონე საკვები დანამატები;
ე) შიგნით მისაღები სამედიცინო დანიშნულების რეაქტივები და რეაგენტები;
ვ) სტომატოლოგიაში გამოსაყენებელი მასალა;
ზ) კონტრაცეპტული მექანიკური საშუალებები;
თ) ჰომეოპათიური საშუალებები;
ი) პარასამკურნალო საშუალებები;
კ) ვეტერინარული სამკურნალო საშუალებები;
ლ) სხვა მწარმოებლის მიერ წარმოებული, საქართველოში უკვე რეგისტრირებულის ანალოგიური სამკურნალო საშუალებები;
მ) ხელახალ რეგისტრაციას დაქვემდებარებული სამკურნალო საშუალებები;
6. წამლის კომპონენტებთან, თერაპიულ ჩვენებასთან, ფორმასთან, დოზასთან, გამოყენების მეთოდთან, ვარგისობის ვადასთან, პირველად შეფუთვასთან, სტანდარტებთან და წარმოების ტექნოლოგიასთან დაკავშირებული ცვლილებები, ექვემდებარება ხელახალ რეგისტრაციას.
7. მე-6 პუნქტში მითითებულის გარდა, ყველა სხვა ცვლილება საჭიროებს სამინისტროსთვის სავალდებულო შეტყობინებას, რომელიც ითვალისწინებს რეგისტრაციის მაძიებლის მიერ სათანადოდ დასაბუთებული ინფორმაციის წარმოდგენას დანართი N21-ის შესაბამისად.
8. სავალდებულო შეტყობინების მიღებიდან, არა უგვიანეს 20 დღის ვადაში, სამინისტრო უფლებამოსილია, წარმოდგენილი მასალის არასრულფასოვნების ან სხვა არგუმენტირებული მოტივაციით უარი განაცხადოს, საქართველოში რეგისტრირებულ საშუალების მიმართ აღნიშნული ცვლილების განხორციელებაზე და ვალდებულია დასაბუთებული უარი მისცეს რეგისტრაციის მაძიებელს.
9. სამინისტრო აუქმებს ან დროებით, რეგისტრაციის შეჩერების მიზეზის აღმოფხვრამდე, აჩერებს საქართველოში სამკურნალო საშუალების რეგისტრაციას, თუ:
ა) სამკურნალო საშუალებას აღმოაჩნდა ადამიანისათვის (ცხოველისათვის) ან მისი შთამომავლობისათვის ზიანის მომტანი თვისება:
ბ) სარეგისტრაციო დოკუმენტაციის წარმოდგენილ ინფორმაციაში შეტანილ იქნა რაიმე ცვლილება, რომელიც დადგენილი წესით და ფორმით არ არის შეთანხმებული ან შეტყობინებული სამინისტროსთან.
10. სარეგისტრაციო პროცედურის ვადის ათვლა იწყება წამლის და ფარმაცევტული საქმიანობის დეპარტამენტისთვის, სარეგისტრაციო მასალების სრულად წარმოდგენის და სათანადო ანგარიშზე, სარეგისტრაციო მოსაკრებლის გადახდის თარიღიდან.
11. დეპარტამენტი სარეგისტრაციო პროცედურის დაწყების თარიღიდან არა უგვიანესს 4 თვის ვადაში იღებს გადაწყვეტილებას სამკურნალო საშუალების რეგისტრაციის ან რეგისტრაციაზე უარის თქმის შესახებ.
12. სარეგისტრაციო მოსაკრებლის გადახდის ანგარიშფაქტურას აქვს გამოწერის თარიღიდან 2 თვის ვადა.
13. რეგისტრაციის მაძიებლის მხრიდან, 2 თვის განმავლობაში სარეგისტრაციო პროცედურის დაწყებისთვის სრული მასალის წარმოუდგენლობის ან/და სარეგისტრაციო მოსაკრებლის გადაუხდელობის შემთხვევაში, წარმოდგენილი მასალა არ ექვემდებარება განხილვას და შენახვას.
14. რეგისტრაციის მაძიებელი პასუხისმგებელია სარეგისტრაციოდ წარმოდგენილი მასალების სისწორეზე.
15. სამკურნალო საშუალების მიმოქცევა საქართველოში ნებადართულია მისი სახელმწიფო რეგისტრაციიდან 5 წლის განმავლობაში.
16. რეგისტრაციაზე უარი შეიძლება გასაჩივრდეს სასამართლოში.
17. ხელახალ რეგისტრაციაზე მასალა წარმოდგენილი უნდა იქნეს, მოქმედი სარეგისტრაციო მოწმობის ვადის გასვლამდე 2 თვით ადრე, წინააღმდეგ შემთხვევაში განიხილება, როგორც ახალი სარეგისტრაციო დოკუმენტები.
18. დოკუმენტები წარმოდგენილი უნდა იქნეს ქართულ ან რუსულ, ან ინგლისურ ენაზე, სამ ეგზემპლარად, მათ შორის სველი წესით დამოწმებული დოკუმენტები სამივე ეგზემპლარში ორიგინალური სახით უნდა იყოს წარმოდგენილი.
19. დოკუმენტების ტექნოლოგიური ნაწილი განიხილება, როგორც სამსახურეობრივი მოხმარების საიდუმლო მასალა.
20. წამლის და ფარმაცევტული საქმიანობის დეპარტამენტი 15 დღის ვადაში ახორციელებს შემოსული სარეგისტრაციო დოკუმენტების და ნიმუშების (შემდგომში, სარეგისტრაციო მასალის) სათანადო დანართთან შესაბამისობის წინასწარ ექსპერტიზას და სარეგისტრაციო მოსაკრებელზე ანგარიშფაქტურის გამოწერას.
21. რეგისტრაციის პროცედურაში მონაწილე ექსპერტები, უფლებამოსილნი არიან, დააყენონ საკითხი წამლის და ფარმაცევტული საქმიანობის დეპარტამენტის წინაშე, დამატებითი ინფორმაციის მიღების საჭიროების თაობაზე, ასეთ შემთხვევაში რეგისტრაციის მაძიებელი ვალდებულია ოპერატიულად უზრუნველყოს დამატებითი ინფორმაციის წარმოდგენა, წამლის და ფარმაცევტული საქმიანობის დეპარტამენტში.
II. სამკურნალო საშუალებათა რეგისტრაციის თანმიმდევრობა
22. სამკურნალო საშუალებათა რეგისტრაციის/ხელახალი რეგისტრაციის თაობაზე და სავალდებულო შეტყობინებით გათვალისწინებული სათანადო მასალები წარედგინება სამინისტროს წამლის და ფარმაცევტული საქმიანობის დეპარტამენტს;
23. რეგისტრაციის მაძიებელი წერილობით მიმართავს წამლის და ფარმაცევტული საქმიანობის დეპარტამენტს, სარეგისტრაციო სამკურნალო საშუალებათა სრული ჩამონათვალის მითითებით, რომელსაც თან უნდა ახლდეს თითოეულ სამკურნალო საშუალებაზე შესაბამისი სარეგისტრაციო დოკუმენტები და სარეგისტრაციო ნიმუშები (შემდგომში - სარეგისტრაციო მასალა), დანართების შესაბამისი სათანადო რაოდენობით;
24. სარეგისტრაციო დოკუმენტები შედგება: ადმინისტრაციული და
მეცნიერული ნაწილისაგან;
25. ადმინისტრაციული ნაწილი შედგება შემდეგი მასალისგან:
ა) დანართი N1 ოთხ ცალად;
ბ) რეგისტრაციის მაძიებლის მიერ, პროდუქციის სარეგისტრაციო საქმიანობის წარმართვაზე, ფიზიკური ან იურიდიული პირისთვის უფლებამოსილების მინიჭების დამადასტურებელი საბუთი;
გ) სარეგისტრაციო საშუალების სტანდარტული შეფუთვა, სტანდარტული მარკირებით;
დ) სამკურნალო საშუალებების წარმოების ლიცენზიის ასლი, გაცემული მწარმოებელი ქვეყნის უფლებამოსილი ორგანოს მიერ;
ე) მწარმოებელ და სხვა ქვეყნებში (ამ უკანასკნელის არსებობის შემთხვევაში) სამკურნალო საშუალების რეგისტრაციის დამადასტურებელი დოკუმენტი;
ვ) სამკურნალო საშუალების გამოყენების ინსტრუქცია, დამოწმებული მწარმოებელი ქვეყნის უფლებამოსილი ორგანოს მიერ;
26. სარეგისტრაციოდ წარმოდგენილი სამკურნალო საშუალებები და შესაბამისი მეცნიერული მონაცემები იყოფა შესაბამისად:
ა) ახალი ორიგინალური სამკურნალო საშუალების რეგისტრაცია/ხელახალი რეგისტრაციისათვის წარმოსადგენი მასალა (ჩამონათვალი იხილეთ შესაბამის დანართში N2 ან N6)
ბ) გენერიკული სამკურნალო საშუალების რეგისტრაცია/ხელახალი რეგისტრაციისათვის წარმოსადგენი მასალა (ჩამონათვალი იხილეთ შესაბამის დანართში N3 ან N4 ან N6)
გ) პარასამკურნალო საშუალების რეგისტრაცია/ხელახალი რეგისტრაციისათვის წარმოსადგენი მასალა (ჩამონათვალი იხილეთ შესაბამის დანართებში N7 ან N8);
დ) სამკურნალო პროფილაქტიკური საშუალების რეგისტრაცია/ხელახალი რეგისტრაციისთვის წარმოსადგენი მასალა (ჩამონათვალი იხილეთ შესაბამის დანართებში N15 ან N16 ან N17);
ე) თერაპიული ეფექტის მქონე საკვები დანამატების რეგისტრაციის/ხელახალი რეგისტრაციისთვის წარმოსადგენი მასალა (ჩამონათვალი იხილეთ დანართი N17);
ვ) ჰომეოპათიური და ანთროფოსოფიული სამკურნალო საშუალების რეგისტრაცია/ხელახალი რეგისტრაციისათვის წარმოსადგენი მასალა (ჩამონათვალი იხილეთ შესაბამის დანართებში N9 ან N10);
ზ) კონტრაცეპტული მექანიკური საშუალების რეგისტრაცია/ხელახალი რეგისტრაციისათვის წარმოსადგენი მასალა (ჩამონათვალი იხილეთ დანართებში N11 ან N12);
თ) სტომატოლოგიური მასალების რეგისტრაცია/ხელახალი რეგისტრაციისათვის წარმოსადგენი მასალა (ჩამონათვალი იხილეთ დანართში N13);
ი) სადიაგნოსტიკო საშუალებების (მათ შორის ალერგენების), რადიოფარმაცევტული საშუალების რეგისტრაცია/ხელახალი რეგისტრაციისათვის წარმოსადგენი მასალა (ჩამონათვალი იხილეთ დანართში N14);
კ) იმუნობიოლოგიური პრეპარატების (ვაქცინები, შრატები) რეგისტრაცია/ხელახალი რეგისტრაციისათვის წარმოსადგენი მასალა (ჩამონათვალი იხილეთ შესაბამისად დანართში N2 ან N3 ან N4 ან N6);
ლ) ვეტერინარული სამკურნალო საშუალებების რეგისტრაცია/ხელახალი რეგისტრაციისათვის წარმოსადგენი მასალა (ჩამონათვალი იხილეთ დანართში N18);
მ) ჰუმანიტარული დახმარების გზით შემოსატანი სამკურნალო საშუალებების რეგისტრაცია/ხელახალი რეგისტრაციისათვის წარმოსადგენი მასალა (ჩამონათვალი იხილეთ შესაბამისად დანართში N19 ან N20);
27. სარეგისტრაციო დოკუმენტაციის წინასწარი ექსპერტიზის და სარეგისტრაციო მოსაკრებელის გადახდის შემდეგ მასალები, სპეციალიზებული შეფასებისთვის გადაეგზავნება თავდაპირველად შრომის, ჯანმრთელობის და სოციალური დაცვის სამინისტროს ფარმაკოპეის კომიტეტს, რომელიც არა უგვიანესს 1 თვის ვადაში იძლევა დასკვნას, დადებითი დასკვნის შემთხვევაში მასალები გადაეცემათ დანარჩენ სამსახურებს შესაბამისად კომპეტენციისა -
ა) საქართველოს შრომის, ჯანმრთელობისა და სოციალური დაცვის სამინისტროს ფარმაკოპეის კომიტეტს (შემდგომში - ფარმაკოპეის კომიტეტი): მიმართვა წამლის და ფარმაცევტული საქმიანობის დეპარტამენტიდან, დანართი N1, ნიმუში და შესაბამისი დოკუმენტები, რეფერენს სტანდარტი (გარდა სადიაგნოსტიკო ტესტსისტემის და რადიოფარმაცევტული საშუალებისა);
ბ) საქართველოს შრომის, ჯანმრთელობისა და სოციალური დაცვის სამინისტროს ფარმაკოლოგიურ კომიტეტს (შემდგომში - ფარმაკოლოგიური კომიტეტი): მიმართვა წამლის და ფარმაცევტული საქმიანობის დეპარტამენტიდან, დანართი N1, ნიმუში და შესაბამისი დოკუმენტები, საჭიროების შემთხვევაში რეფერენს სტანდარტი;
გ) წამლის ხარისხის კონტროლის ცენტრს: მიმართვა წამლის და ფარმაცევტული საქმიანობის დეპარტამენტიდან, ლაბორატორიის ტექნიკური კომპეტენტურობის ფარგლებში სამკურნალო საშუალების (გარდა ვეტერინარული საშუალებებისა) ნიმუშის სტანდარტთან შესაბამისობის ანალიზური დასკვნისთვის (თანდართული ანგარიშით), ნიმუშები-1 ანალიზის ჩასატარებელი საკმარისი რაოდენობით, შესაბამისი დოკუმენტები და რეფერენსსტანდარტი.
დ) საქართველოს სოფლის მეურნეობისა და სურსათის სამინისტროს ვეტერინარიის დეპარტამენტს: (ვეტერინალური სამკურნალო საშუალებების შემთხვევაში), მიმართვა წამლის და ფარმაცევტული საქმიანობის დეპარტამენტიდან, დანართი N1, შესაბამისი დოკუმენტაცია, ნიმუშები და რეფერენს - სტანდარტი.
28. დასკვნები სამკურნალო საშუალების რეგისტრაციის თაობაზე მიიღება კომიტეტების სხდომაზე და ფორმდება ოქმის სახით. ფარმაკოპეის და ფარმაკოლოგიური კომიტეტების დასკვნებს ხელს აწერენ შესაბამისი კომიტეტის თავმჯდომარეები, საქართველოს სოფლის მეურნეობისა და სურსათის სამინისტროს ვეტერინარიის დეპარტამენტის ბიოლოგიურ-ფარმაკოლოგიური კომისიის დასკვნას ხელს აწერს შესაბამისი კომისიის თავმჯდომარე და დასკვნას თან უნდა ერთვოდეს ვეტერინარული სამკურნალო საშუალების ხარისხის კონტროლის ლაბორატორიის დასკვნა, ნიმუშის სტანდარტთან შესაბამისობის თაობაზე;
29.
ა) წამლის ხარისხის კონტროლის ლაბორატორია, ჩატარებული ანალიზ(ებ)ის საფუძველზე, ამზადებს დასკვნას სარეგისტრაციო ნიმუშის სტანდარტთან შესაბამისობის შესახებ, რომელსაც ანალიზის ანგარიშთან ერთად 1 თვემდე ვადაში (თუ წამლის სპეციფიკაციით უფრო ხანგრძლივი ვადა არ არის საჭირო), წარმოადგენს წამლის და ფარმაცევტული საქმიანობის დეპარტამენტში.
ბ) თუ ანალიზური მეთოდით გათვალისწინებული გამოცდა აღემატება მის ტექნიკურ კომპეტენტურობას, ამის თაობაზე ლაბორატორია დაუყოვნებლივ აწვდის წერილობით ინფორმაციას წამლის და ფარმაცევტული საქმიანობის დეპარტამენტს;
30. საჭიროების შემთხვევაში წამლის და ფარმაცევტული საქმიანობის დეპარტამენტს და კომიტეტებს, უფლება აქვთ სარეგისტრაციო მასალის განხილვაში დამატებით ჩართონ კომპეტენტური ექსპერტები, რომლებიც საკუთარ დასკვნებს პირადად აწერენ ხელს და პასუხს აგებენ მის მართებულობაზე;
31. წამლის ინსტრუქციის ქართული ტექსტის პროექტს, წამლის რეგისტრაციის პროცესში ამზადებს ფარმაკოლოგიური კომიტეტი;
32. სამკურნალო საშუალებები კლინიკურ კვლევას ექვემდებარებიან შერჩევით. კვლევის ჩატარების აუცილებლობის შესახებ გადაწყვეტილებას იღებს ფარმაკოლოგიური კომიტეტი. კლინიკურ კვლევაზე სამკურნალო საშუალებების გადაცემა ხორციელდება შრომის, ჯანმრთელობის და სოციალური დაცვის სამინისტროს მიერ უფლებამოსილ სამედიცინო დაწესებულებებში;
33. თუ სარეგისტრაციოდ წარმოდგენილი სადიაგნოსტიკო საშუალება (ტესტსისტემა), რადიოფარმაცევტული საშუალებები და სტომატოლოგიური მასალები მიეკუთვნება რეგისტრირებული მწარმოებელი კომპანიის მიერ უკვე დარეგისტრირებულ ნოზოლოგიას, ივსება დამატებითი დანართი, მომდევნო რიგითობით, რომელშიც მითითებულია ნოზოლოგიის სახელი, შესაბამისი კოდები, სარეგისტრაციო მოწმობის ნომერი;
34.
ა) სადიაგნოსტიკო ტესტ-სისტემების სარეგისტრაციო მოწმობის დანართს ფარმაკოლოგიური კომიტეტი ავსებს საკუთარი დასკვნის საფუძველზე და ხელს აწერს ფარმაკოლოგიური კომიტეტის თავმჯდომარე, ხოლო ვეტერინარული სადიაგნოსტიკო საშუალების შემთხვევაში დანართი ივსება აღნიშნული წესით, ვეტერინარული დეპარტამენტის დასკვნის საფუძველზე;
ბ) სტომატოლოგიური მასალის სარეგისტრაციო მოწმობის დანართს ფარმაკოლოგიური და ფარმაკოპეის კომიტეტების საექსპერტო დასკვნების საფუძველზე, ავსებს ფარმაკოლოგიური კომიტეტი და ხელს აწერს თავმჯდომარე;
35. შემოსული დასკვნების საფუძველზე, წამლის და ფარმაცევტული საქმიანობის დეპარტამენტი იღებს გადაწყვეტილებას სამკურნალო საშუალების რეგისტრაციის ან რეგისტრაციაზე უარის შესახებ. დადებითი გადაწყვეტილების შემთხვევაში, წამლის და ფარმაცევტული საქმიანობის დეპარტამენტი აფორმებს სარეგისტრაციო მოწმობას ხელმოსაწერად, რომელშიც მითითებული უნდა იქნეს სარეგისტრაციო მოწმობის ნომერი, მწარმოებელი, მწარმოებელი ქვეყანა და რეგისტრაციის უფლების მქონე სხვა სუბიექტი (მისი არსებობის შემთხვევაში), სამკურნალო საშუალების სავაჭრო და საერთაშორისო არაპატენტირებული სახელი, პროდუქტის ფარმაკოლოგიური ჯგუფი, ფორმა დოზა, შეფუთვის მოცულობა, სარეგისტრაციო მოწმობის გაცემის თარიღი და მოქმედების ვადა (შესაბამისად დანართი N22 ან N23 ან N24);
36. სარეგისტრაციო მოწმობას, მის დანართს და სამკურნალო საშუალების გამოყენების ინსტრუქციას ქართულ ენაზე ამტკიცებს შრომის, ჯანმრთელობისა და სოციალური დაცვის მინისტრი;
37. რეგისტრაციის მაძიებელს, სარეგისტრაციო მოწმობასთან ერთად, გადაეცემა აღნიშნული სამკურნალო საშუალებების გამოყენების ქართულენოვანი, 39-ე პუნქტის შესაბამისად, დამტკიცებული ინსტრუქცია.
III. რეგისტრირებულ სამკურნალო საშუალებების დოკუმენტებში ცვლილებების შეტანის პროცედურა
38. შრომის, ჯანმრთელობისა და სოციალური დაცვის სამინისტრო, რეგისტრაციის მაძიებლის მხრიდან დადგენილი წესით და ფორმით ინფორმირებული უნდა იქნეს სამკურნალო საშუალებებთან დაკავშირებული ნებისმიერი ცვლილების თაობაზე;
39. ხელახალი რეგისტრაციის პროცედურა ანალოგიურია რეგისტრაციის პროცედურის;
40. სავალდებულო შეტყობინებას დაქვემდებარებული ცვლილებების თაობაზე ინფორმაცია წარმოდგენილი უნდა იქნეს დანართი N21 - ის შესაბამისად;
41. რეგისტრაციის მაძიებლის მიერ წარმოდგენილი მასალა ცვლილებების თაობაზე, წამლის და ფარმაცევტული საქმიანობის დეპარტამენტის მიერ, ამ წესით უკვე დადგენილი პროცედურით, გადაეცემა რეგისტრაციაში მონაწილე სამსახურებს, რომლებიც თავის მხრივ წარმოადგენენ შესაბამის დასკვნებს. აუცილებლობის შემთხვევაში წამლის და ფარმაცევტული საქმიანობის დეპარტამენტი უფლებამოსილია მოიწვიოს სხდომა, რომელსაც დაესწრება ექსპერტიზაში მონაწილე ყველა სამსახურის ხელმძღვანელი და საჭიროების შემთხვევაში მოწვეული სპეციალისტები. სხდომა თავის გადაწყვეტილებას აფორმებს ოქმის სახით.
IV. ტერმინები და განმარტებები
42. სამკურნალო საშუალების რეგისტრაცია - საქართველოში წარმოებული და საზღვარგარეთიდან შემოტანილი სამკურნალო საშუალების სახელმწიფო ექსპერტიზის პროცედურა, რომლის საფუძველზედაც გაიცემა სახელმწიფოში მისი მიმოქცევის ნებართვა.
43. საქართველოს სამკურნალო საშუალებების სახელმწიფო რეგისტრი - ცნობარი, რომელიც მოიცავს საქართველოში წარმოებისათვის და სამედიცინო პრაქტიკაში გამოყენებისათვის ნებადართული სამკურნალო საშუალებების ნუსხას;
44. სარეგისტრაციო მოწმობა - სამკურნალო საშუალებების სახელმწიფო რეგისტრაციის დამადასტურებელი მკაცრი აღრიცხვის დოკუმენტი;
45. სამკურნალო საშუალება (ფარმაცევტული პროდუქტი) - წამალი ან ფიზიოლოგიურად აქტიური, ბუნებრივი ან სინთეზური გზით მიღებული სამკურნალო ნივთიერება ან მათი კომბინაცია, რომლებიც ნებადართულია სამედიცინო გამოყენებისათვის.
46. წამალი (სამკურნალწამლო საშუალება, მედიკამენტი) - ნივთიერება ან ნივთიერებათა კომბინაცია ფარმაცევტული პრეპარატის სახით, რომელიც გამოიყენება ფიზიოლოგიური სისტემის გამოსაკვლევად, ადამიანის და ცხოველის რეპროდუქციული ფუნქციის სარეგულირებლად, პათოლოგიური მდგომარეობის თავიდან აცილებლად ან რეციპიენტის სასარგებლოდ შესაცვლელად.
47. ფარმაცევტული პრეპარატი (წამლის ფორმა) - გარკვეული ფორმის სახით არსებული (მათ შორის: აბი, კაფსულა, ტაბლეტი, ამპულა, სანთელი, კაპლეტი, დრაჟე) კონკრეტული დოზირებული მზა წამალი.
48. დოზა - წამლის გარკვეული რაოდენობა, რომელიც ერთ მიღებაზე შეიყვანება ორგანიზმში.
49. გენერიკული სამკურნალო საშუალება - საერთაშორისო, არაპატენტირებული სამკურნალო საშუალება.
50. ბიოშეღწევადობა - სამკურნალო საშუალების დოზირებული ფორმიდან აქტიური სუბსტანციის ათვისების სისწრაფე და ხარისხი.
51. ბიოექვივალენტურობა - ორი სამკურნალო საშუალების ტოლფასოვნება, თუ ისინი არ განსხვავდებიან ერთმანეთისაგან წამლის ფორმით და თანაბარი მოლური დოზით შეყვანის შემთხვევაში მათი ბიოშეღწევადობა ერთნაირია, რაც განაპირობებს მოსალოდნელი ძირითადი ეფექტების იდენტურობას.
52. სადიაგნოსტიკო საშუალება - საშუალება, რომლის გამოყენებაც გათვალისწინებულია ორგანიზმის ფიზიოლოგიური ან პათოლოგიური მდგომარეობის შესწავლის მიზნით.
53. რადიოფარმაცევტული საშუალება - საშუალება, რომელიც შეიცავს რადიოაქტიურ იზოტოპს და გათვალისწინებულია გამოყენებისათვის დიაგნოსტიკური ან თერაპიული მიზნით.
54. რადიაქტიული დიაგნოსტიკური სამკურნალო საშუალება - მაიონიზირებელი გამოსხივების თვისების მქონე, სამედიცინო პრაქტიკაში გამოყენებული საშუალება.
55. პარასამკურნალო საშუალება - გარკვეული თერაპიული ეფექტის მქონე მცენარეული, ცხოველური ან მინერალური წარმოშობის საშუალება, რომელიც შეიცავს წამლის სპეციფიურ სუბსტანციას ისეთი სახითა და რაოდენობით, რომელიც შეიძლება მიჩნეულ იქნეს წამლის ფორმად.
56. ჰომეოპათიური სამკურნალო საშუალება - ქიმიური, მცენარეული, მინერალური ან ცხოველური წარმოშობის სამკურნალო ნივთიერება ან ნივთიერებათა ჯამი, რომელიც დამზადებულია შესაბამის ჰომეოპათიურ ფარმაკოპეაში მოყვანილი მეთოდების მიხედვით და გამოიყენება როგორც კლასიკურ ჰომეოპათიაში, ასევე მის სხვადასხვა მიმართულებებში.
57. თერაპიული ეფექტის მქონე საკვები დანამატი - კვების პროდუქტის შემავსებელი საკვები დანამატისა და აქტიური ქიმიური ინგრედიენტისაგან შემდგარი ნარევი, რომელიც გამოიყენება დაავადების პროფილაქტიკის ან მკურნალობის მიზნით.
58. იმუნობიოლოგიური
59. კონტრაცეპტული მექანიკური საშუალება - ორსულობის თავიდან ასაცილებელი საშუალება საშვილოსნოს შიგნით შეყვანის გზით.
60. კონდომი (პრეზერვატივი) - ორსულობის თავიდან ასაცილებელი ბარიერული საშუალება.
61. სტომატოლოგიური მასალებია:
ა) ამალგამები;
ბ) კომპოზიტი პასტა/პასტა;
გ) კომპოზიტი სინათლეზე გამყარებადი;
დ) კომპომერი;
ე) მინისებრი იონმერი;
ვ) გრავირების გელი, სითხე;
ზ) ადჰეზიური მასალები;
თ) ფისისებური სილანტები;
ი) ცემენტები;
კ) სარჩულები;
ლ) საფიქსაციო ცემენტები;
მ) დროებითი ბჟენები.
62. სამკურნალო-პროფილაქტიკური მინერალური წყალი - ენტერალური გზით მისაღები წყალი, რომელიც გამოიყენება სხვადასხვა დაავადების პროფილაქტიკისა და მკურნალობის მიზნით.
63. სამკურნალო-პროფილაქტიკური კოსმეტიკური და ჰიგიენური საშუალება - საშუალება, რომელიც გამოიყენება კანის დაზიანებისა და დაავადებების მკურნალობის და პროფილაქტიკის მიზნით.
64. სამკურნალო-პროფილაქტიკური კბილის პასტა და საღეჭი რეზინი - პროდუქტი, რომელიც გამოიყენება კბილებისა და ღრძილების დაავადების მკურნალობისა და პროფილაქტიკის მიზნით.
65. ანთროფოსოფიული სამკურნალო საშუალება - უპირატესად მინერალური, მცენარეული და ცხოველური ნედლეულიდან მიღებული ან სპეციფიკური ქიმიური სინთეზის გზით შემუშავებული მარტივი ან კომპლექსური ნაერთი, რომელიც დამზადებულია ანთროფოსოფიული მეთოდით და გამოიყენება ანთროფოსოფიული თერაპიული მიმართულების შესაბამისად, რაც ითვალისწინებს ბუნების შემეცნების პრინციპებს სხვადასხვა დაავადებებთან მიმართებაში.
66. ტრადიციული სამკურნალო საშუალება - არაოფიცინალური მარტივი ან რთული ნარევი, რომლის უსაფრთხოება, ეფექტი და ხარისხი არ არის დადგენილი მეცნიერულად და ისტორიული წყაროების თანახმად გამოიყენება საქართველოში ემპირიული სახით მკურნალობის მიზნით. ტრადიციული მედიცინით მკურნალობა დაყრდნობილია მომხმარებლის რწმენაზე და საფუძვლებს იღებს საქართველოს ტრადიციებიდან.
67. რეფერენს სტანდარტი (სტანდარტული ნიმუში) - ზუსტად დადგენილი თვისების მქონე სუბსტანცია, რომელიც გამოიყენება ნივთიერების ხარისხის შესაფასებლად..
68. პირველადი შეფუთვა - შეფუთვის ფორმა, რომელიც უშუალოდ ეხება სამკურნალო საშუალებას.
69. მეორეული შეფუთვა - შეფუთვის ფორმა, რომელშიც თავსდება სამკურნალო საშუალება პირველადი შეფუთვით.
70. მარკირება - ინფორმაცია, რომელიც წარმოდგენილია პირველად ან/და მეორეულ შეფუთვაზე.
71. ინსტრუქცია - მომხმარებლისათვის განკუთვნილ ფურცელზე წარმოდგენილი ინფორმაცია, რომელიც თან ახლავს სამკურნალო საშუალებას.
72. სამკურნალო საშუალების ეფექტიანობა - დაავადების მიმდინარეობაზე სამკურნალო საშუალების დადებითი ზემოქმედების მეცნიერული მეთოდებით დადგენილი ხარისხის მახასიათებელი.
73. სამკურნალო საშუალების უსაფრთხოობა - სამკურნალო საშუალების ეფექტიანობის და მის მიერ ჯანმრთელობის ზიანის გამოწვევის რისკის შეფასების შედარებით ანალიზზე დამყარებული მახასიათებელი.
74. ლაბორატორიის ტექნიკური კომპეტენტურობა - დადგენილი წესით, ოფიციალურად დადასტურებული კონკრეტული გამოცდის ან/და კონკრეტული ტიპის გამოცდ(ებ)ის ჩატარების სათანადო შესაძლებლობა.
75. სარეგისტრაციო დოკუმენტაციის წინასწარი ექსპერტიზა - ითვალისწინებს რეგისტრაციის/ხელახალი რეგისტრაციისთვის წარმოდგებილი მასალის კვალიფიცირებას, წარმოდგენილი დოკუმენტების სათანადო დანართთან შესაბამისობის, იურიდიული გაფორმების შემოწმებას და სათანადო საგადასახადო დავალების გამოწერას.
დანართი N 1
სამკურნალო საშუალების სავაჭრო დასახელება: |
ათქ - კოდი |
საერთაშორისო არაპატენტირებული |
ხელახალი რეგისტრაცია |
ძირითადი სინონიმები: |
კომპონენტის რეგისტრაცია |
|
თერაპიული ჩვენების რეგისტრაცია |
ფარმაკოლოგიური ჯგუფი: |
ფორმის რეგისტრაცია |
ფორმა (შეფუთვის მითითებით) |
დოზის რეგისტრაცია |
შემადგენლობა (დოზა) |
გამოყენების მეთოდის რეგისტრაცია |
|
ვარგისობის ვადების რეგისტრაცია
|
|
პირველადი შეფუთვის რეგისტრაცია |
|
სპეციფიკაციების რეგისტრაცია |
|
წარმოების ტექნოლოგიაში |
|
გ ა ც ე მ ა |
|
რეცეპტით |
|
ურეცეპტოდ |
სამკურნალო საშუალების ჩვენებები, მიღების წესი: |
|
აქტიური სუბსტანცია (ები), მათი რაოდენობა დოზის ერთეულში |
|
შენახვის წესები |
|
(-18 ც0) (+2-8 ც0) (+8-15 ც0) (ოთახის ტემპერატურა) |
|
შენახვის ვადა |
|
მწარმოებელი: |
|
რეგისტრაციის უფლების მქონე სხვა სუბიექტი : |
|
ტელ: |
|
ფაქსი: |
|
ელ-ფოსტა: |
|
ელ-ფოსტა:
ტელ: |
|
დანართი N2
ახალი ორიგინალური სამკურნალო საშუალების რეგისტრაციისათვის წარმოსადგენი
მასალა
1.* სამკურნალო საშუალების დასახელება;
2.* ინფორმაცია (რეზიუმე) სამკურნალო საშუალების შესახებ;
3.* სამკურნალო საშუალებების გამოყენების ინსტრუქცია;
4. მწარმოებელ ქვეყანაში სამკურნალო საშუალების რეგისტრაციის დამადასტურებელი საბუთი ან ფარმაცევტული პროდუქტის სერტიფიკატი, მჯოს მიერ რეკომენდებული ფორმით (ორიგინალი);
5.*
ა) მონოგრაფიები აქტიური სუბსტანციის(ების) შესახებ (სტრუქტურული ფორმულის, სპეციფიკაციის და ანალიზის მეთოდების ჩათვლით);
ბ) სამკურნალო საშუალების ფარმაკოპეის სტატია (ორიგინალი);
6.*აქტიური სუბსტანციის მიღების მეთოდი, თითოეული მათგანის მიღების წყარო, საწარმოს დასახელება და მისამართი;
7.* არააქტიური სუბსტანციის დასახელება, იდენტიფიკაციის, სისუფთავის, ხარისხის ანალიზის მეთოდის ჩათვლით (აღნიშნული უნდა იქნეს ფარმაკოპეის დასახელება და გამოცემა), მისი მიღების წყარო და მწარმოებელის მისამართი;
8.* სამკურნალო საშუალების წარმოების მეთოდი;
9. წამლის ნიმუშები (5-ს დამატებული ანალიზისთვის საჭირო რაოდენობა);
10. აქტიური სუბსტანციის (ების) რეფერენს სტანდარტები (ანალიზის ჩასატარებლად საკმარისი რაოდენობით);
11. სამკურნალო საშუალების ხარისხის სერტიფიკატი დამოწმებული შესაბამისი სახელმწიფო ორგანოს მიერ (ორიგინალი);
12.* მონაცემები პრეპარატის სტაბილურობის შესახებ;
13.სამკურნალო საშუალების საერთაშორისო (GMP) სტანდარტით წარმოების დამადასტურებელი საბუთი, გაცემული უფლებამოსილი ორგანოს მიერ (ორიგინალი).
14.* წინაკლინიკური კვლევის მონაცემები სამკურნალო საშუალების სპეციფიური ფარმაკოლოგიური აქტივობის შესახებ, რომელიც შეიცავს შემდეგ მონაცემებს:
ა) ზოგადი ფარმაკოდინამიური ეფექტი;
ბ) მოქმედების მექანიზმი;
გ) ფარმაკოდინამიკური აქტივობა;
დ) სხვა წამლებთან ურთიერთქმედება.
15.* ფარმაკოკინეტიკური მონაცემები ცხოველებზე ჩატარებული ექსპერიმენტებით, რომელიც შეიცავს:
ა) ნახევრად გამოყოფის პერიოდის განსაზღვრას;
ბ) მონაცემებს პლაცენტური ბარიერის ან დედის რძის მეშვეობით განვლადობის შესახებ;
გ) მონაცემებს მეტაბოლიტების თერაპიული მოქმედების ან ტოქსიკური ეფექტის და მათი კუმულაციის უნარის შესახებ;
დ) აქტიური მეტაბოლიტების არსებობის შემთხვევაში საჭიროა მონაცემები მათი ფარმაკოკინეტიკის შესახებ.
16.* ტოქსიკოლოგიური მონაცემები, რომელიც შეიცავს:
ა) სამკურნალო საშუალების შეყვანის გზას და ადამიანზე გამოყენების სავარაუდო ხანგრძლივობას;
ბ) ინტეგრალურ მონაცემებს;
გ) ბიოქიმიური ანალიზის მონაცემები;
დ) პათომორფოლოგიური კვლევის მონაცემებს;
ე) მონაცემებს მწვავე ტოქსიკურობის შესახებ;
ვ) მონაცემებს ქვემწვავე და ქრონიკული ტოქსიკურობის შესახებ.
17.* კვლევა რეპროდუქციის უნარზე, ტერატოგენობაზე, ემბრიოტოქსიურობაზე;
18.* მუტაგენობა ინ ვიტრო და ინ ვივო;
19.* კანცეროგენობა (საჭიროების შემთხვევაში);
20.* ალერგენობა;
21.* ადგილობრივი გამაღიზიანებელი მოქმედება;
22.* კლინიკური მონაცემები:
ა) ფარმაკოდინამიკა, გვერდითი ეფექტები, განსაკუთრებით სპეციფიური ჯგუფის პაციენტებისათვის (ხანდაზმულები, ბავშვები და ა.შ.);
ბ) განსაზღრული უნდა იქნეს მინიმალური ეფექტური დოზა და თერაპიული ინდექსი;
23.* ფარმაკოკინეტიკური მონაცემები:
24.* ანგარიში სამკურნალო საშუალების კლინიკური კვლევის შესახებ (სამეცნიერო სტატიები, პუბლიკაციები სამკურნალო საშუალების კლინიკური კვლევის შედეგების შესახებ);
25.* შეჯამებული მონაცემები გვერდითი ეფექტების შესახებ, მათი შედარება იმავე ჩვენების მქონე სხვა სამკურნალო საშუალებასთან;
26.* სამკურნალო საშუალების კლინიკური გამოყენების გამოცდილება:
ა) სამკურნალო საშუალების ეფექტურობა და უსაფრთხოება, შედარებული სხვა სამკურნალო საშუალებებთან;
ბ) ყველა მოხსენება გვერდითი ეფექტების შესახებ;
გ) სხვა წამლებთან ურთიერთქმედება;
დ) პუბლიკაციების ჩამონათვალი (პუბლიკაციების ასლები);
27. სტანდარტული შეფუთვა და მარკირება (ფალსიფიცირებისაგან დამცავი მექანიზმების მითითებით (თუ ასეთი არის);
28.* ბიბლიოგრაფია;
29.* მარკეტინგული შეზღუდვები
ა) მხოლოდ რეცეპტით (1ან სხვა შეზღუდვები);
ბ) საპატენტო შეზღუდვები (თუ ასეთი არის).
__________________
შენიშვნა: *ით აღნიშნული მონაცემები, შეიძლება წარმოდგენილი იქნეს ელექტრონული ვერსიით, ხოლო „ორიგინალურის“ სახით მოთხოვნის შემთხვევაში, უფლებამოსილი ორგანოს მიერ სველი წესით დამოწმებული საბუთის სახით.
დანართი N3
ლიცენზიით კვლავწარმოებული
გენერიული სამკურნალო საშუალების
რეგისტრაციისათვის წარმოსადგენი მასალა
1.* სამკურნალო საშუალების დასახელება;
2.* ინფორმაცია (რეზიუმე) სამკურნალო საშუალებების შესახებ;
3.* სამკურნალო საშუალების გამოყენების ინსტრუქცია;
4.* ქიმიური შემადგენლობა, ყველა მასში შემავალი ინგრედიენტის და დოზის ერთეულში მათი რაოდენობის ჩათვლით;
5. ლიცენზია სამკურნალო საშუალების წარმოებაზე (ორიგინალი).
6. სამკურნალო საშუალების წარმოების სტანდარტი (საერთაშორისო, ნაციონალური...) დადასტურებული უფლებამოსილი ორგანოს მიერ (ორიგინალი).
7. აქტიური სუბსტანციის წარმოშობის სერტიფიკატი (ორიგინალი);
8. ფარმაკოპეული სტატია (ფარმაკოპეის დასახელებისა და გამოცემის აღნიშვნით) (ორიგინალი);
9. სტანდარტული შეფუთვა ფალსიფიცირებისაგან დამცავი მექანიზმების მითითებით (თუ ასეთი არსებობს);
10. სამკურნალო საშუალების ხარისხის სერტიფიკატი დამოწმებული სახელმწიფო ორგანოს მიერ (ორიგინალი);
11. წამლის ნიმუშები (5 -ს დამატებული ანალიზისთვის საჭირო რაოდენობა);
12. აქტიური სუბსტანციის (ების) რეფერენსსტანდარტები (ანალიზის ჩასატარებლად საკმარისი რაოდენობით);
13.* სამკურნალო საშუალების ბიოექვივალენტურობის დამადასტურებელი კვლევის მონაცემები;
____________________
შენიშვნა: *ით აღნიშნული მონაცემები, შეიძლება წარმოდგენილ იქნეს ელექტრონული ვერსიით, ხოლო „ორიგინალურის“ სახით მოთხოვნის შემთხვევაში, უფლებამოსილი ორგანოს მიერ სველი წესით დამოწმებული საბუთის სახით.
დანართი N4
საკუთარი ტექნოლოგიით კვლავწარმოებული გენერიკული
სამკურნალო საშუალების რეგისტრაციისათვის წარმოსადგენი მასალა
1.* სამკურნალო საშუალების დასახელება;
2. დანართი N2-ში ჩამოთვლილი საბუთები (პუნქტები 211);
3. ლიცენზია სამკურნალო საშუალების წარმოებაზე (ორიგინალი);
4.* მონაცემები წარმოდგენილი სამკურნალო საშუალების და ორიგინალური სამკურნალო საშუალების ბიოშეღწევადობის და ბიოექვივალენტურობის შესახებ;
5. სტანდარტული შეფუთვა და მარკირება ფალსიფიცირებისაგან დამცავი მექანიზმების მითითებით (თუ ასეთი არსებობს).
_____________________
შენიშვნა: *ით აღნიშნული მონაცემები, შეიძლება წარმოდგენილ იქნეს ელექტრონული ვერსიით, ხოლო „ორიგინალურის“ სახით მოთხოვნის შემთხვევაში, უფლებამოსილი ორგანოს მიერ სველი წესით დამოწმებული საბუთის სახით.
დანართი N5
რეგისტრირებული სამკურნალო საშუალების ახალი ფორმის (პედიატრიულის ჩათვლით), ახალი ჩვენების, ახალი დოზის სარეგისტრაციოდ წარმოსადგენი მასალა
1.* სამკურნალო საშუალების დასახელება;
2. დანართი N2-ში ჩამოთვლილი საბუთები (პუნქტები 1,2,412,23,25);
3.* მონაცემები წარმოდგენილი სამკურნალო საშუალებების და ორიგინალური სამკურნალო საშუალების ბიოშეღწევადობის შესახებ;
4. სტანდარტული შეფუთვა და მარკირება ფალსიფიცირებისაგან დამცავი მექანიზმების მითითებით, თუ ასეთი არსებობს.
___________________
შენიშვნა: *ით აღნიშნული მონაცემები, შეიძლება წარმოდგენილ იქნეს ელექტრონული ვერსიით, ხოლო „ორიგინალურის“ სახით მოთხოვნის შემთხვევაში, უფლებამოსილი ორგანოს მიერ სველი წესით დამოწმებული საბუთის სახით.
დანართი N6
სამკურნალო საშუალების
ხელახალი რეგისტრაციისათვის წარმოსადგენი მასალა
1.* სამკურნალო საშუალების დასახელება;
2.* ინფორმაცია (რეზიუმე) სამკურნალო საშუალებების შესახებ;
3. აქტიური სუბსტანციის წარმოშობის სერტიფიკატი (ორიგინალი);
4. მზა სამკურნალო საშუალების ხარისხის სერტიფიკატი (ორიგინალი);
5. ფარმაკოპეული სტატია (ორიგინალი);
6. მწარმოებელ ქვეყანაში სამკურნალო საშუალების რეგისტრაციის დამადასტურებელი საბუთი (ორიგინალი);
7. სამკურნალო საშუალების წარმოების სტანდარტის (საერთაშორისო, ნაციონალური...) დამადასტურებელი საბუთი გაცემული უფლებამოსილი ორგანოს მიერ (ორიგინალი);
8. წამლის ნიმუშები (5-ს დამატებული ანალიზისთვის საჭირო რაოდენობა);
9. აქტიური სუბსტანციის(ების) რეფერენს სტანდარტები (ანალიზის ჩასატარებლად საკმარისი რაოდენობით);
10.* სამკურნალო საშუალების გამოყენების ინსტრუქცია;
11.* დამატებითი ინფორმაცია სამკურნალო საშუალების გვერდითი ეფექტების შესახებ და მისი კლინიკური გამოყენების გამოცდილება;
12.* ინფორმაცია ქიმიური, წარმოების ან კონტროლის პროცესის ცვლილების შესახებ, რომელიც ადრე არ იყო წარმოდგენილი.
13. სტანდარტული შეფუთვა და მარკირება ფალსიფიცირებისაგან დამცავი მექანიზმების მითითებით (თუ ასეთი არსებობს).
____________________
შენიშვნა: *ით აღნიშნული მონაცემები, შეიძლება წარმოდგენილ იქნეს ელექტრონული ვერსიით, ხოლო „ორიგინალურის“ სახით მოთხოვნის შემთხვევაში, უფლებამოსილი ორგანოს მიერ სველი წესით დამოწმებული საბუთის სახით.
დანართი N7
პარასამკურნალო საშუალების,
რეგისტრაციისათვის წარმოსადგენი მასალა
1.* სამკურნალო საშუალების დასახელება;
2.* ინფორმაცია (რეზიუმე) სამკურნალო საშუალების შესახებ;
3.* შემადგენლობა;
4. ფარმაკოპეის სტატია (ორიგინალი);
5. სამკურნალო საშუალების ხარისხის სერტიფიკატი (ორიგინალი);
6.* წარმოების ტექნოლოგია;
7. წამლის ნიმუშები (5-ს დამატებული ანალიზისთვის საჭირო რაოდენობა);
8. მწარმოებელ ქვეყანაში რეგისტრაციის დამადასტურებელი საბუთი (ორიგინალი);
9.* მონაცემები სამკურნალო საშუალების უსაფრთხოების და ეფექტურობის შესახებ;
10.* გამოყენების ინსტრუქცია;
11. წარმოების ლიცენზია (ორიგინალი);
12.წარმოების სტანდარტის დამადასტურებელი დოკუმენტი (მისი არსებობისას), გაცემული უფლებამოსილი ორგანოების მიერ (ორიგინალი);
13. სტანდარტული შეფუთვა და მარკირება ფალსიფიცირებისაგან დამცავი მექანიზმების მითითებით (თუ ასეთი არსებობს).
_________________
შენიშვნა: *ით აღნიშნული მონაცემები, შეიძლება წარმოდგენილ იქნეს ელექტრონული ვერსიით, ხოლო „ორიგინალურის“ სახით მოთხოვნის შემთხვევაში, უფლებამოსილი ორგანოს მიერ სველი წესით დამოწმებული საბუთის სახით.
დანართი N8
პარასამკურნალო საშუალების
ხელახალი რეგისტრაციისათვის წარმოსადგენი მასალა
1.* სამკურნალო საშუალების სახელწოდება;
2.* ზოგადი ინფორმაცია (რეზიუმე) პარასამკურნალო საშუალების შესახებ;
4.* შემადგენლობა;
5. ფარმაკოპეული სტატია (ორიგინალი);
6. მწარმოებელ ქვეყანაში პარასამკურნალო საშუალების რეგისტრაციის დამადასტურებელი საბუთი (ორიგინალი);
7. სამკურნალო საშუალების ხარისხის სერტიფიკატი (ორიგინალი);
8. სტანდარტული შეფუთვა და მარკირება ფალსიფიცირებისაგან დამცავი მექანიზმების მითითებით (თუ ასეთი არსებობს);
9. წამლის ნიმუშები (5-ს დამატებული ანალიზისთვის საჭირო რაოდენობა);
_________________
შენიშვნა: *ით აღნიშნული მონაცემები, შეიძლება წარმოდგენილ იქნეს ელექტრონული ვერსიით, ხოლო „ორიგინალურის“ სახით მოთხოვნის შემთხვევაში, უფლებამოსილი ორგანოს მიერ სველი წესით დამოწმებული საბუთის სახით.
დანართი N9
ჰომეოპათიური და ანთროფოსოფიული
სამკურნალო საშუალების რეგისტრაციისათვის წარმოსადგენი მასალა
1.* სამკურნალო საშუალების დასახელება;
2.* ზოგადი ინფორმაცია (რეზიუმე)სამკურნალო საშუალებების შესახებ;
3.* სამკურნალო საშუალების შემადგენლობა;
4. ლიცენზია სამკურნალო საშუალების წარმოებაზე (ორიგინალი);
5. მწარმოებელ ქვეყანაში სამკურნალო საშუალებების რეგისტრაციის დამადასტურებელი საბუთი (ორიგინალი);
6. სახელმწიფო სტანდარტები/ფარმაკოპეის სტატია (ორიგინალი);
7.* მონაცემები უსაფრთხოების და ეფექტურობის შესახებ;
8.* გამოყენების ინსტრუქცია;
9. სტანდარტული შეფუთვა და მარკირება, ფალსიფიცირებისაგან დამცავი მექანიზმების მითითებით (თუ ასეთი არსებობს);
10. წამლის 5 ნიმუში.
__________________
შენიშვნა: *ით აღნიშნული მონაცემები, შეიძლება წარმოდგენილ იქნეს ელექტრონული ვერსიით, ხოლო „ორიგინალურის“ სახით მოთხოვნის შემთხვევაში, უფლებამოსილი ორგანოს მიერ სველი წესით დამოწმებული საბუთის სახით.
დანართი N10
ჰომეოპათიური და ანთროფოსოფიული
სამკურნალო საშუალების ხელახალი რეგისტრაციისათვის წარმოსადგენი მასალა
1.* სამკურნალო საშუალების დასახელება;
2.* ზოგადი ინფორმაცია (რეზიუმე) სამკურნალო საშუალებების შესახებ;
3.* გამოყენების ინსტრუქცია;
4.* სამკურნალო საშუალების შემადგენლობა;
5. ლიცენზია სამკურნალო საშუალების წარმოებაზე (ორიგინალი);
6. მწარმოებელ ქვეყანაში სამკურნალო საშუალებების რეგისტრაციის დამადასტურებელი საბუთი (ორიგინალი);
7. სახელმწიფო სტანდარტები/ფარმაკოპეის სტატია;
8. სტანდარტული შეფუთვა და მარკირება, ფალსიფიცირებისაგან დამცავი მექანიზმების მითითებით (თუ ასეთი არსებობს);
9. წამლის 5 ნიმუში.
________________
შენიშვნა: *ით აღნიშნული მონაცემები, შეიძლება წარმოდგენილ იქნეს ელექტრონული ვერსიით, ხოლო „ორიგინალურის“ სახით მოთხოვნის შემთხვევაში, უფლებამოსილი ორგანოს მიერ სველი წესით დამოწმებული საბუთის სახით.
დანართი N11
კონტრაცეპტიული მექანიკური
საშუალებების რეგისტრაციისათვის წარმოსადგენი მასალა
1.* საშუალების დასახელება;
2.* ზოგადი ინფორმაცია საშუალების შესახებ;
3.* საწარმოს დასახელება, მისამართი;
4.* შემადგენლობა;
5. ხარისხის სერტიფიკატი (ორიგინალი);
6.* სახელმწიფო სტანდარტი;
7. საშუალების 5 ნიმუში;
8. მწარმოებელ ქვეყანაში საშუალებების რეგისტრაციის დამადასტურებელი საბუთი (ორიგინალი);
9.* მონაცემები გამოყენებისა და უსაფრთხოების შესახებ;
10. ლიცენზია საშუალებების წარმოებაზე (ორიგინალი);
11. სტანდარტული შეფუთვა და მარკირება, ფალსიფიცირებისაგან დამცავი მექანიზმების მითითებით (თუ ასეთი არსებობს).
----------------
შენიშვნა: *ით აღნიშნული მონაცემები, შეიძლება წარმოდგენილ იქნეს ელექტრონული ვერსიით, ხოლო „ორიგინალურის“ სახით მოთხოვნის შემთხვევაში, უფლებამოსილი ორგანოს მიერ სველი წესით დამოწმებული საბუთის სახით.
დანართი N12
კონტრაცეპტიული მექანიკური
საშუალებების ხელახალი რეგისტრაციისათვის წარმოსადგენი მასალა
1.* საშუალების დასახელება;
2.* ზოგადი ინფორმაცია საშუალების შესახებ;
3.* ზოგადი ინფორმაცია გამოყენების შედეგების შესახებ;
4.* საწარმოს დასახელება და მისამართი;
5. ხარისხის სერტიფიკატი (ორიგინალი);
6.* სახელმწიფო სტანდარტი;
7. საშუალების 5 ნიმუში;
8. მწარმოებელ ქვეყანაში საშუალებების რეგისტრაციის დამადასტურებელი საბუთი(ორიგინალი);
9.* მონაცემები მისი გამოყენების შესახებ;
10. ლიცენზია საშუალების წარმოებაზე (ორიგინალი);
11. სტანდარტული შეფუთვა და მარკირება, ფალსიფიცირებისაგან დამცავი მექანიზმების მითითებით (თუ ასეთი არსებობს).
__________________
შენიშვნა: *ით აღნიშნული მონაცემები, შეიძლება წარმოდგენილ იქნეს ელექტრონული ვერსიით, ხოლო „ორიგინალურის“ სახით მოთხოვნის შემთხვევაში, უფლებამოსილი ორგანოს მიერ სველი წესით დამოწმებული საბუთის სახით.
დანართი N13
სტომატოლოგიური მასალის რეგისტრაციისათვის
და ხელახალი რეგისტრაციისათვის წარმოსადგენი მასალა
1.* საშუალების დასახელება
2.* გამოყენების ინსტრუქცია;
3. ხარისხის სერტიფიკატი (ორიგინალი);
4.*მონაცემები უსაფრთხოების შესახებ;
5. სტანდარტული შეფუთვა მარკირება, ფალსიფიცირებისაგან დამცავი მექანიზმების მითითებით (თუ ასეთი არსებობს);
6. მწარმოებელ და სხვა ქვეყნებში სტომატოლოგიური საშუალებების რეგისტრაციის დამადასტურებელი საბუთი(ორიგინალი);
7. სტომატოლოგიური საშუალების 3 ნიმუში.
____________________
შენიშვნა: *ით აღნიშნული მონაცემები, შეიძლება წარმოდგენილ იქნეს ელექტრონული ვერსიით, ხოლო „ორიგინალურის“ სახით მოთხოვნის შემთხვევაში, უფლებამოსილი ორგანოს მიერ სველი წესით დამოწმებული საბუთის სახით.
დანართი N14
სადიაგნოსტიკო საშუალების (ტესტსისტემა)და რადიოფარმაცევტული
საშუალების,ალერგენების, შიგნით მისაღები რეაქტივების და რეაგენტების
რეგისტრაციასა და ხელახალი რეგისტრაციისათვის წარმოსადგენი მასალა
1.* ჩამონათვალი კატალოგის ნომრების მითითებით;
2.* მწარმოებელი ფირმის კატალოგი;
3. სტანდარტული შეფუთვამარკირება;
4.* უსაფრთხოების და ეფექტურობის დამადასტურებელი მონაცემები
(სამკურნალო რადიოფარმაცევტული და ალერგენის შემთხვევაში).
_________________
შენიშვნა: *ით აღნიშნული მონაცემები, შეიძლება წარმოდგენილ იქნეს ელექტრონული ვერსიით ხოლო „ორიგინალურის“ სახით მოთხოვნის შემთხვევაში, უფლებამოსილი ორგანოს მიერ სველი წესით დამოწმებული საბუთის სახით.
დანართი N15
სამკურნალო-პროფილაქტიკური
მინერალური წყლის რეგისტრაციისათვის წარმოსადგენი მასალა
1.* სამკურნალო-პროფილაქტიკური მინერალური წყლის დასახელება;
2.* ზოგადი ინფორმაცია სამკურნალო-პროფილაქტიკური მინერალური წყლის შესახებ;
3.* სამკურნალო-პროფილაქტიკური მინერალური წყლის გამოყენების ინსტრუქცია;
4. ლიცენზია წარმოებაზე (ორიგინალი);
5. სამკურნალო-პროფილაქტიკური მინერალური წყლის 6 ნიმუში;
6. ხარისხის სერტიფიკატი (ორიგინალი);
7. სახელმწიფო სტანდარტი (ორიგინალი);
8.* კლინიკური მონაცემები;
9. სტანდარტული შეფუთვა და მარკირება, ფალსიფიცირებისაგან დამცავი მექანიზმების მითითებით (თუ ასეთი არსებობს);
_____________________
შენიშვნა: *ით აღნიშნული მონაცემები, შეიძლება წარმოდგენილ იქნეს ელექტრონული ვერსიით, ხოლო „ორიგინალურის“ სახით მოთხოვნის შემთხვევაში, უფლებამოსილი ორგანოს მიერ სველი წესით დამოწმებული საბუთის სახით.
დანართი N16
სამკურნალო-პროფილაქტიკური
მინერალური წყლის ხელახალი რეგისტრაციისათვის წარმოსადგენი მასალა
1.* სამკურნალო-პროფილაქტიკური მინერალური წყლის დასახელება;
2.* ზოგადი ინფორმაცია სამკურნალო-პროფილაქტიკური მინერალური წყლის შესახებ;
3.* სამკურნალო-პროფილაქტიკური მინერალური წყლის გამოყენების ინსტრუქცია;
4. სამკურნალო-პროფილაქტიკური მინერალური წყლის 6 ნიმუში;
5. ხარისხის სერტიფიკატი (ორიგინალი);
6. სახელმწიფო სტანდარტი (ორიგინალი);
7.* ზოგადი მონაცემები გამოყენების შესახებ;
8. სტანდარტული შეფუთვა და მარკირება, ფალსიფიცირებისაგან დამცავი მექანიზმების მითითებით (თუ ასეთი არსებობს);
9.* ბიბლიოგრაფია.
___________________
შენიშვნა: *ით აღნიშნული მონაცემები, შეიძლება წარმოდგენილ იქნეს ელექტრონული ვერსიით, ხოლო „ორიგინალურის“ სახით მოთხოვნის შემთხვევაში, უფლებამოსილი ორგანოს მიერ სველი წესით დამოწმებული საბუთის სახით.
დანართი N17
სამკურნალო პროფილაქტიკური: კბილის პასტის,
საღეჭი რეზინის, კოსმეტიკური და ჰიგიენური საშუალებების
და თერაპიული ეფექტის მქონე საკვები დანამატების რეგისტრაციისათვის
და ხელახალი რეგისტრაციისათვის წარმოსადგენი მასალა
1.*საშუალების დასახელება;
2.*ზოგადი ინფორმაცია საშუალების შესახებ;
3.*შემადგენლობა;
4.*ტექნიკური პირობები (სტანდარტი);
5. ხარისხის სერტიფიკატი (ორიგინალი);
6. ჰიგიენური სერტიფიკატი (ორიგინალი);
7.*გამოყენების ინსტრუქცია;
8.* მონაცემები უსაფრთხოების და ეფექტურობის შესახებ;
9. მწარმოებელ ქვეყანაში რეგისტრაციის დამადასტურებელი საბუთი (ორიგინალი);
10. წარმოების ლიცენზია (ორიგინალი);
11. საშუალების ნიმუში (5ს დამატებული ანალიზისთვის საჭირო რაოდენობა).
__________________
შენიშვნა: *ით აღნიშნული მონაცემები, შეიძლება წარმოდგენილ იქნეს ელექტრონული ვერსიით, ხოლო „ორიგინალურის“ სახით მოთხოვნის შემთხვევაში, უფლებამოსილი ორგანოს მიერ სველი წესით დამოწმებული საბუთის სახით.
დანართი N18
ვეტერინალური სამკურნალო საშუალებების
რეგისტრაციის და ხელახალი რეგისტრაციისათვის წარმოსადგენი მასალა
1.* სამკურნალო საშუალების დასახელება;
2.* ინფორმაცია (რეზიუმე) სამკურნალო საშუალებების შესახებ;
3.* სათანადო მონაცემები სამკურნალო საშუალების უსაფრთხოების და ეფექტურობის შესახებ;
4.* სამკურნალო საშუალების გამოყენების ინსტრუქცია;
5.* ქიმიური შემადგენლობა, ყველა მასში შემავალი ინგრედიენტის და დოზის ერთეულში მათი რაოდენობის ჩათვლით;
6. ლიცენზია სამკურნალო საშუალების წარმოებაზე (ორიგინალი);
7. მწარმოებელ ქვეყანაში სამკურნალო საშუალების რეგისტრაციის დამადასტურებელი მოწმობა (ორიგინალი);
8. სამკურნალო საშუალების წარმოების სტანდარტი (საერთაშორისო, ნაციონალური...) დადასტურებული უფლებამოსილი ორგანოს მიერ (ორიგინალი);
9. აქტიური სუბსტანციის წარმოშობის სერტიფიკატი (ორიგინალი);
10. ფარმაკოპეული სტატია (ფარმაკოპეის დასახელებისა და გამოცემის აღნიშვნით) ორიგინალი;
11. სამკურნალო საშუალების რეფერენსსტანდარტი;
12.სტანდარტული შეფუთვა, ფალსიფიცირებისაგან დამცავი მექანიზმების მითითებით (თუ ასეთი არსებობს);
13. სამკურნალო საშუალების ხარისხის სერტიფიკატი დამოწმებული სახელმწიფო ორგანოს მიერ (ორიგინალი);
14. სამკურნალო საშუალების 6 ნიმუშს დამატებული ანალიზისთვის საჭირო რაოდენობა.
_________________
შენიშვნა: *ით აღნიშნული მონაცემები, შეიძლება წარმოდგენილ იქნეს ელექტრონული ვერსიით, ხოლო „ორიგინალურის“ სახით მოთხოვნის შემთხვევაში, უფლებამოსილი ორგანოს მიერ სველი წესით დამოწმებული საბუთის სახით.
დანართი N19
საქართველოში ჰუმანიტარული გზით შემოსატანი
სამკურნალო საშუალებათა რეგისტრაციის განაცხადი
სამკურნალო საშუალების სავაჭრო დასახელება: |
ათქ - კოდი |
საერთაშორისო არაპატენტირებული |
ხელახალი რეგისტრაცია |
ძირითადი სინონიმები: |
კომპონენტის რეგისტრაცია |
|
თერაპიული ჩვენების რეგისტრაცია |
ფარმაკოლოგიური ჯგუფი: |
ფორმის რეგისტრაცია |
ფორმა (შეფუთვის მითითებით) |
დოზის რეგისტრაცია |
შემადგენლობა (დოზა) |
გამოყენების მეთოდის რეგისტრაცია |
|
ვარგისობის ვადების რეგისტრაცია
|
|
პირველადი შეფუთვის რეგისტრაცია |
|
სპეციფიკაციების რეგისტრაცია |
|
წარმოების ტექნოლოგიაში |
|
გ ა ც ე მ ა |
|
რეცეპტით |
|
ურეცეპტოდ |
სამკურნალო საშუალების ჩვენებები, მიღების წესი: |
|
აქტიური სუბსტანცია (ები), მათი რაოდენობა დოზის ერთეულში |
|
შენახვის წესები |
|
(-18 ც0) (+2-8 ც0) (+8-15 ც0) (ოთახის ტემპერატურა) |
|
შენახვის ვადა |
|
მწარმოებელი: |
|
რეგისტრაციის უფლების მქონე სხვა სუბიექტი : |
|
ტელ: |
|
ფაქსი: |
|
ელ-ფოსტა: |
|
ელ-ფოსტა:
ტელ: |
|
დანართი N20
ჰუმანიტარული დახმარების გზით შემოსატანი
სამკურნალო საშუალებების რეგისტრაციისათვის წარმოსადგენი მასალა
1. განაცხადი დონორის წარმომადგენელი ორგანიზაციიდან;
2.* ჩამონათვალი იმ ქვეყნებისა, რომელშიც რეგისტრირებულია აღნიშნული სამკურნალო საშუალება;
3.*სამკურნალო საშუალების გამოყენების ინსტრუქცია;
4. სამკურნალო საშუალების ხარისხის სერთიფიკატი (ორიგინალი);
5. სტანდარტული შეფუთვა-მარკირება;
6. ფარმაკოპეის სტატია (სახელმწიფო სტანდარტი);
7. სამკურნალო საშუალების საერთაშორისო (GMP) სტანდარტით წარმოების დამადასტურებელი საბუთი, გაცემული უფლებამოსილი ორგანოს მიერ (ორიგინალი).
8. დასკვნა, სამედიცინო პროგრამების მართვის და ჯანდაცვის პოლიტიკის დეპარტამეტებიდან, სამკურნალო საშუალების სახელმწიფო სამედიცინო პროგრამის განხორციელებისთვის, გამოყენების თაობაზე.
9. სამკურნალო საშუალების 2 ნიმუში.
_____________________
შენიშვნა: *-ით აღნიშნული მონაცემები, შეიძლება წარმოდგენილ იქნეს ელექტრონული ვერსიით, ხოლო „ორიგინალურის“ სახით მოთხოვნის შემთხვევაში, უფლებამოსილი ორგანოს მიერ სველი წესით დამოწმებული საბუთის სახით.
დანართი 21
სავალდებულო შეტყობინებით
წარმოსადგენი ინფორმაციის თაობაზე
N |
ცვლილების სახე აუცილებელი პირობა |
ცვლილების სახე აუცილებელი პირობა |
1 |
ვლილებები წარმოების ლიცენზიაში |
სავალდებულოა ცვლილებების თაობაზე სათანადო ლიცენზიის ან/და ლიცენზიის დანართის წარმოდგენა |
2
3 |
სამკურნალო საშუალების სახელწოდების შეცვლა
რეგისტრაციის უფლების მქონე სკუბიექტის, დასახელების ან იურიდიული მისამართის შეცვლა * |
არ უნდა არსებობდეს ახალი სახელწოდების, საერთაშორისო არაპატენტირებული ან/და უკვე რეგისტრირებული სამკურნალო საშუალებების სახელებში აღრევის რისკი. წარმოდგენილ უნდა იქნეს:
* რეგისტრაციის მაძიებლის წერილობითი ცნობა, რომ სამკურნალო საშუალებასთან მიმართებაში არაფერი შეცვილალა სახელწოდების გარდა * გამოყენების ინსტრუქციის, ეტიკეტის, ან/და სამკურნალო საშუალების დასამტკიცებელი ნიმუშები, * ცნობა იმის თაობაზე, თუ როდის იქნება სამკურნალო საშუალება ახალი სახელწოდებით საქართველოს ბაზარზე შემოტანილი ფაქტიურად არ უნდა იცვლებოდეს მწარმოებელი, დასაშვებია შეიცვალოს მწარმოებლის სავაჭრო ლიცენზიის მფლობელი და ყველა კონკრეტულ შემთხვევაში წარმოდგენილ უნდა იქნეს უფლებამოსილების და ვალდებულებების დამადსტურებელი სათანადო დოკუმენტები და ნიმუშები ახალი მარკირებით. |
5 |
აქტიური ინგრედიენტის ან/და მზა პროდუქციის სერიის/პარტიის მოცულობის შეცვლა
შენახვის პირობების შეცვლა |
წარმოდგენილი უნდა იქნეს * მწარმოებლის ცნობა, რომ არ ირღვევა წარმოებისპროცესის მთლიანობა * პროდუქციის ახალი სერიის/პარტიის ხარისხის სერთიპიკატი წარმოდგენილ უნდა იქნეს * ცვლილების დასაბუთება * სტაბილურობის სათანადო ანალიზის მონაცემები (რითაც უნდა დადასტურებულ იქნეს, რომ სპეციფიკაციით ნაჩვენები ვადა არ იცვლება) |
6 |
პრეპარ ატის შესაყვანი მოწყობილობის გამოცდის მეთოდში ცვლილება |
წარმოდგენილ უნდა იქნეს * ვალიდაციის მონაცემები, რითაც დადასტურებულ უნდა იყოს, წინა მეთოდთან შედარებით, მისი უპირატესობა |
7 |
ვეტერინარული სამკურნალო საშუალებების შეფუთვის მოცულობის ცვლილება* |
წარმოდგენილ უნდა იქნეს * ცვლილების დასაბუთება ინფორმაცია. რომ იცვლება პრეპარატის სპეციფიკაცია, დოზირების რეჟიმი, გამოყენების ხანგრძლივობა; (ცვლილება არ უნდა შეეხოს პარენტერალურ საშუალებებს). * ახალი ნიმუშები |
8 |
ცვლილება შეფუთვის მარკირებაში |
* უნდა შეესაბამებოდეს საქართველოს მოქმედ კანონმდებლობას და წარმოდგენილ იქნეს * ცვლილების დასაბუთება * ახალი ნიმუშები |
9 |
ფარმაცევტული პრეპარატის ზომის შეცვლა |
უპირობოდ არ უნდა იცვლებოდეს პრეპარატის ხსნადობის მაჩვენებელები და წარმოდგენილ უნდა იქნეს * ცვლილების დასაბუთება * შედარებით ი ანალიზის მონაცემები * ახალი ნიმუშები |
10 |
მეორეული შეფუთვის დიზაინის შეცვლა
|
უნდა შეესაბამებოდეს მოქმედ კანონმდებლობას და წარმოდგენილ უნდა იქნეს * ცვლილების დასაბუთება * შესაბამისი ნიმუშები
|
11 |
უშუალოდ ფარმაცევტულ პრეპარატზე მარკირების შეცვლა |
ახალმა აღნიშვნებმა არ უნდა გამოიწვიოს პრეპარატის სხვა პრეპარატში აღრევა და წარმოდგენილ იქნეს * ცვლილების დასაბუთება * ახალი ნიმუშები
|
|
და ა. შ. |
|
დანართი 3
ამონაწერი
სარეგისტრაციო მოსაკრებლების შესახებ კანონიდან
საქართველოს შრომის, ჯანმრთელობისა და სოციალური დაცვის სამინისტროს შესაბამისი სამსახურები ახორციელებენ შემდეგი სახის რეგისტრაციას:
ა) სამკურნალო საშუალების რეგისტრაცია ან/და ხელახალი რეგისტრაცია - 1000 ლარი;
ბ) რეგისტრირებული სამკურნალო საშუალების დოზის, ფორმის რეგისტრაცია ან/და ხელახალი რეგისტრაცია - 500 ლარი;
გ) პარასამკურნალო საშუალების რეგისტრაცია ან/და ხელახალი რეგისტრაცია - 200 ლარი;
დ) რეგისტრირებული პარასამკურნალო საშუალების დოზის, ფორმის რეგისტრაცია ან/და ხელახალი რეგისტრაცია - 100 ლარი;
ე) ჰომეოპათიური სამკურნალო საშუალების რეგისტრაცია ან/და ხელახალი რეგისტრაცია - 400 ლარი;
ვ) რეგისტრირებული ჰომეოპათიური სამკურნალო საშუალების ფორმის რეგისტრაცია ან/და ხელახალი რეგისტრაცია - 100 ლარი;
ზ) დიაგნოსტიკური და რადიოფარმაცევტული საშუალების რეგისტრაცია ან/და ხელახალი რეგისტრაცია - 400 ლარი;
თ) კონტრაცეპტიული მექანიკური საშუალების რეგისტრაცია ან/და ხელახალი რეგისტრაცია - 400 ლარი;
ი) სამკურნალო-პროფილაქტიკური საშუალების რეგისტრაცია ან/და ხელახალი რეგისტრაცია - 800 ლარი;
კ) თერაპიული ეფექტის მქონე კვებითი დანამატის რეგისტრაცია ან/და ხელახალი რეგისტრაცია - 600 ლარი;
ლ) სტომატოლოგიური მასალის რეგისტრაცია ან/და ხელახალი რეგისტრაცია - 600 ლარი;
მ) სამედიცინო ტექნიკური ნაკეთობების და სამედიცინო დანიშნულების საგნების რეგისტრაცია - 1000 ლარი;
ნ) სამედიცინო ტექნიკური ნაკეთობების და სამედიცინო დანიშნულების საგნების მოდერნიზებული მოდელების რეგისტრაცია - 330 ლარი;
ო) სამედიცინო ტექნიკური ნაკეთობების და სამედიცინო დანიშნულების საგნების ხელახალი რეგისტრაცია - 250 ლარი;
პ) ერთჯერადი გამოყენების სამედიცინო ტექნიკური ნაკეთობების და სამედიცინო დანიშნულების საგნების რეგისტრაცია - 500 ლარი;
ჟ) ერთჯერადი გამოყენების სამედიცინო ტექნიკური ნაკეთობების და სამედიცინო დანიშნულების საგნების მოდერნიზებული მოდელების რეგისტრაცია - 170 ლარი;
რ) ერთჯერადი გამოყენების სამედიცინო ტექნიკური ნაკეთობების და სა მედიცინო დანიშნულების საგნების ხელახალი რეგისტრაცია - 125 ლარი;
ს) ბიოლოგიური პრეპარატების რეგისტრაცია:
ს.ა) სასოფლო-სამეურნეო და შინაურ ცხოველთა ვირუსული დაავადებების ვაქცინისა - 960 ლარი;
ს.ბ) ფრინველთა ვირუსული დაავადებების ვაქცინისა - 1200 ლარი;
ს.გ) სასოფლო-სამეურნეო და შინაურ ცხოველთა ბაქტერიული დაავადებების ვაქცინისა - 750 ლარი;
ს.დ) ფრინველთა ბაქტერიული დაავადებების ვაქცინისა - 1000 ლარი;
ს.ე) ვაქცინების გამხსნელებისა - 640 ლარი;
ს.ვ) ფაგი-გლობულინის სამკურნალო და პროფილაქტიკური შრატების, ვირუსული და ბაქტერიული დაავადებების დიაგნოსტიკუმების თითოეული ჯგუფისა - 500 ლარი;
ტ) ფარმაკოლოგიური პრეპარატების რეგისტრაცია:
ტ.ა) ანტიმიკრობული ანტიბიოტიკების, ვირუსული სულფანილამიდების თითოეული ჯგუფისა - 1000 ლარი
ტ.ბ) სოკოვანი დაავადებების საწინააღმდეგო საშუალებებისა:
ტ.ბ.ა) ნიტროფურაზების და ფუნგიციდებისა - 1000 ლარი;
ტ.ბ.ბ) ყველა სხვა ანტიმიკრობული საშუალებისა - 700 ლარი;
ტ.ბ.გ) ანტივირუსული საშუალებებისა - 1000 ლარი;
ტ.ბ.დ) ანტიპარაზიტული საშუალებების (ანტიპროტოზოული, ანტიჰელმინთური, ინსექტოაკარიციდები) თითოეული ჯგუფისა - 1000 ლარი;
ტ.გ) ნივთიერებათა ცვლის პრეპარატებისა:
ტ.გ.ა) დერატონიციტების, ჰორმონების, ფერმენტების, ამინომჟავების თითოეული ჯგუფისა - 500 ლარი; ტ.გ.ბ) ვიტამინებისა - 320 ლარი;
ტ.გ.გ) შაქრების, მინერალური ნივთიერებების, ქსოვილოვანი პრეპარატების თითოეული ჯგუფისა - 250 ლარი;
ტ.დ) საჭმლის მომნელებელი სისტემის პრეპარატებისა:
ტ.დ.ა) ლორწოვანი ადსორბენტებისა - 256 ლარი;
ტ.დ.ბ) კუჭის შემკვრელი ადსორბენტების, გამაღიზიანებლების, ამოსაღებინებლების და ფაშვის რუმინატორების თითოეული ჯგუფისა - 200 ლარი;
ტ.ე) სისხლძარღვთა სისტემის პრეპარატებისა:
ტ.ე.ა) გლუკოზიდების, ერითროპოეზის საშუალებების, სისხლის შემადედებლების თითოეული ჯგუფისა - 200 ლარი;
ტ.ე.ბ) იმუნომოდულატორებისა - 500 ლარი;
ტ.ვ) სასუნთქი სისტემის პრეპარატების (სუნთქვის აღმგზნებები, ამოსახველებლები) თითოეული ჯგუფისა - 200 ლარი;
ტ.ზ) შარდსასქესო და სარძევე ჯირკვლების პრეპარატებისა:
ტ.ზ.ა) შარდმდენებისა - 200 ლარი;
ტ.ზ.ბ) საშვილოსნოს, მასტიტების საწინააღმდეგო, ხელოვნური დათესვლის საშუალებების თითოეული ჯგუფისა - 500 ლარი;
ტ.თ) ცენტრალური ნერვული სისტემის პრეპარატებისა: (ცნს-ის დამთრგუნავები, ცნს -ის აღმგზნებები) თითოეული ჯგუფისა - 200 ლარი;
უ) სარეგისტრაციო დოკუმენტაციაში ცვლილებების შეტანა, რაც არ ექვემდებარება ხელახალ რეგისტრაციას - 50 ლარი.
_______________
* იმ სპეციალობებში რომელთა სერტიფიცირების პროცესი დაწყებულია
** ამ დებულებით გათვალისწინებული სამედიცინო სასწავლებლების აკრედიტაციის სავალდებულობა არ ვრცელდება იმ კურსდამთავრებულებზე, რომლებმაც დაამთავრეს შესაბამისი სახელმწიფო (ლიცენზიის მინიჭების წესის ძალაში შესვლამდე) ან სახელმწიფო თუ კერძო სასწავლებელი აკრედიტაციის წესის ძალაში
შესვლამდე.